题目内容
19.几种短周期元素的原子半径及主要化合价如表所示,下列说法正确的是( )| 元素代号 | X | Y | Z | M | R |
| 原子半径(×10-10m) | 1.60 | 1.86 | 0.75 | 0.74 | 1.02 |
| 主要化合价 | +2 | +1 | +5,-3 | -2 | +6,-2 |
| A. | Z的最高价氧化物对应的水化物与其最简单氢化物反应生成的化合物中含离子键和极性键 | |
| B. | 最简单氢化物的稳定性:Z>M | |
| C. | 最简单氢化物的沸点高低顺序为:R>M | |
| D. | 最高价氧化物对应水化物的碱性强弱顺序为:X>Y |
分析 短周期元素中,M、R都有-2价,处于ⅥA族元素,R有+6价,M无正价,且M的原子半径较大,则R为S元素、M为O元素;X、Y化合价分别为+2、+1价,则分别处于ⅡA族、IA族,且原子半径Y>X>硫,故X为Mg、Y为Na;Z有+5、-3价,处于ⅤA族,原子半径小于硫的,故Z为N元素,据此解答.
解答 解:短周期元素中,M、R都有-2价,处于ⅥA族元素,R有+6价,M无正价,且M的原子半径较大,则R为S元素、M为O元素;X、Y化合价分别为+2、+1价,则分别处于ⅡA族、IA族,且原子半径Y>X>硫,故X为Mg、Y为Na;Z有+5、-3价,处于ⅤA族,原子半径小于硫的,故Z为N元素.
A.Z的最高价氧化物对应的水化物与其最简单氢化物反应生成的化合物为硝酸铵,含离子键和极性键,故A正确;
B.非金属性M(O)>Z(N),故氢化物稳定性M(O)>Z(N),故B错误;
C.水分子之间存在氢键,沸点高于硫化氢的,故C错误;
D.金属性Na>Mg,故碱性:氢氧化钠>氢氧化镁,故D错误.
故选A.
点评 本题考查结构性质位置关系应用,根据化合价及原子半径推断元素是解题关键,注意对元素周期律的理解掌握,注意氢键对位置性质的影响.

练习册系列答案
 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
9.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号).原子结构示意图为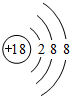 .
.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的名称是KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的化学方程式Al2O3+2OH-=2AlO2-+H2O.
(4)元素④与⑦的化合物属于离子(填“共价”或“离子”)化合物.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的名称是KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的化学方程式Al2O3+2OH-=2AlO2-+H2O.
(4)元素④与⑦的化合物属于离子(填“共价”或“离子”)化合物.
10.A、B、C、D、E 是同一短周期的五种元素,A和B的最高价氧化物对应的水化物呈碱性,且碱性前者强于后者,C和D的最高价氧化物对应的水化物溶液呈酸性,且酸性前者强于后者,五种元素形成的简单离子中,E的离子半径最小,则它们的原子序数由大到小的顺序是( )
| A. | B A D C E | B. | E C D A B | C. | A B E D C | D. | C D E B A |
14.下列实验方案不能达到实验目的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向1mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 除去甲烷中的乙烯 | 将混合气通入溴水洗气 |
| D | 探究温度对化学平衡的影响 | 将NO2球浸泡在冷、热水中,观察颜色的变化 |
| A. | A | B. | B | C. | C | D. | D |
4.1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298.以下叙述不正确的是( )
| A. | 该元素属于第七周期 | |
| B. | 该元素位于ⅢA 族 | |
| C. | 该元素为金属元素,性质与Pb相似 | |
| D. | 该同位家原子含有114个电子,184个中子 |
11.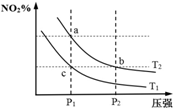 在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
 在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
在密闭容器中发生反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | 反应温度:T1>T2 | B. | b、c两点的反应速率:v(b)>v(c) | ||
| C. | a、c两点气体的颜色:a浅,c深 | D. | a、b两点的平衡常数:Kb>Ka |
8.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )


| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b连接时,铜片上发生氧化反应 |
 :2,2,4三甲基-戊烷;
:2,2,4三甲基-戊烷; :间甲基苯乙烯.
:间甲基苯乙烯.