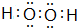题目内容
19. 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题:(1)图中ABCDE五点的KW间的关系是B>C>A=D=E.
(2)若从A点到D点,可采用的措施是c.
a.升温
b.加入少量的盐酸
c.加入少量的NH4Cl
(3)点B对应温度条件下,某溶液pH═7,此时,溶液呈碱性(酸、碱、中性),点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为10:1.
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+pH2=14.
分析 (1)水的离子积常数只与温度有关,温度越高,离子积常数越大;
(2)从A点到D点c(H+)变大,c(OH-)变小,但Kw不变;
(3)点B对应温度条件下,pH═6溶液呈中性,而溶液pH═7,说明溶液呈碱性;E对应的温度下,Kw=10-14,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则酸溶液中的n(H+)等于碱溶液中的n(OH-),据此计算;
(4)在100℃时,水的离子积Kw=10-12,酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定强酸的pH1与强碱的pH2之间应满足的关系.
解答 解:(1)水的离子积常数只与温度有关,温度越高,离子积常数越大,同一曲线是相同温度,根据图知,温度高低点顺序是B>C>A=D=E,所以离子积常数大小顺序是B>C>A=D=E,故答案为:B>C>A=D=E;
(2)在A点时,c(H+)=c(OH-),溶液显中性,而到D点c(H+)变大,c(OH-)变小,溶液显酸性,即由A点到D点,溶液由中性变为酸性,但Kw不变.
a、升高温度,Kw变大,故a错误;
b、加入NaOH,则溶液显碱性,故b错误;
c、加入氯化铵,水解显酸性,且Kw不变,故c正确.
故选c;
(3)点B对应温度条件下,pH═6溶液呈中性,而溶液pH═7,说明溶液呈碱性;E对应的温度下,Kw=10-14,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则酸溶液中的n(H+)等于碱溶液中的n(OH-),故有:10-5mol/L×V碱=10-4mol/L×V酸,解得:$\frac{{V}_{碱}}{{V}_{酸}}$=$\frac{10}{1}$,故答案为:碱性;10:1;
(4)100℃时,水的离子积为10-12,即酸、碱浓度相等时pH1+pH2=12.现强碱的OH-浓度是强酸H+浓度的100倍,所以pH1+pH2=14,故答案为:pH1+pH2=14.
点评 本题考查酸碱混合的定性判断和溶液PH的有关计算,题目难度中等,注意酸碱混合时酸碱物质的量的关系以及溶液PH与c(H+)、(OH-)的关系.

 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 24.60 |
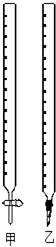
(1)如图中甲为酸式滴定管,乙为碱式 滴定管(填“酸式”或“碱式”)
(2)实验中,需要润洗的仪器是:(酸、碱式)滴定管
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂.滴定终点的判断依据是红色褪去,半分钟不再出现红色
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果偏高
(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果偏低.
(5)未知浓度的NaOH溶液的物质的量浓度为0.1288 mol/l.
| A. | 原子半径按X、Y、Z的顺序增大 | |
| B. | 单质的氧化性按X、Y、Z的顺序减弱 | |
| C. | 元素的非金属性按X、Y、Z的顺序增强 | |
| D. | 气态氢化物稳定性按X、Y、Z的顺序减弱 |
| A. | pH=1的溶液:Ag+、Al3+、Cl-、SO42- | |
| B. | 能使甲基橙溶液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液:NH4+、Cu2+、NO3-、Cl- | |
| D. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
| A. | 用酸碱中和滴定法测待测液浓度时,装标准液的滴定管用水洗后未用标准液润洗 | |
| B. | 用酸碱中和滴定法测待测液浓度时,装待测液的锥形瓶用水洗后用待测液润洗2~3次 | |
| C. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| D. | 用蒸馏水湿润的pH试纸测定硫酸钠溶液的pH |
| A. | 离子半径:Na+>Mg2+>Al3+>F- | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:SiO2>NaCl>I2>CO2 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
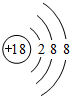 .
.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的名称是KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的化学方程式Al2O3+2OH-=2AlO2-+H2O.
(4)元素④与⑦的化合物属于离子(填“共价”或“离子”)化合物.