题目内容
14.下列反应可用离子方程式“H++OH-=H2O”表示的是( )| A. | H2SO4溶液与Ba(OH)2溶液混合 | B. | HCl与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与氨水混合 | D. | NaHCO3溶液与NaOH溶液混合 |
分析 离子方程式“H++OH-=H2O”表示强酸与可溶性强碱反应生成可溶性盐和水的一类反应,据此进行解答.
解答 解:A.H2SO4溶液与Ba(OH)2溶液反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故A错误;
B.HCl与Ca(OH)2溶液混合,氢氧化钙需要拆开,反应的离子方程式为:H++OH-=H2O,故B正确;
C.HNO3溶液与氨水混合,氨水为弱碱,一水合氨不能拆开,该反应不能用“H++OH-=H2O”表示,故C错误;
D.NaHCO3溶液与NaOH溶液混合,碳酸氢根离子不能拆开,该反应不能用“H++OH-=H2O”表示,故D错误;
故选B.
点评 本题考查了离子方程式的书写方法,为高考的高频题,题目难度不大,明确离子方程式表示意义为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.Mg-AgCl 电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg═Mg2++2Ag+2Cl-.有关该电池的说法正确的是( )
| A. | Mg 为电池的正极 | |
| B. | 负极反应为 AgCl+e-=Ag+Cl- | |
| C. | 可用于海上应急照明供电 | |
| D. | 电池工作时,电解质溶液质量不断减轻 |
7.常温下0.1mol/LNH4Cl溶液的pH最接近于( )
| A. | 1 | B. | 5 | C. | 7 | D. | 13 |
2.下列物质一定属于同系物的是( )
①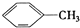
②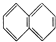
③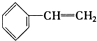
④C2H4
⑤CH2=CH-CH=CH2
⑥C3H6
⑦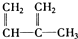
⑧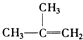
①

②

③

④C2H4
⑤CH2=CH-CH=CH2
⑥C3H6
⑦
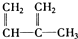
⑧

| A. | ④和⑧ | B. | ①、②和③ | C. | ④和⑤ | D. | ④、⑥和⑧ |
9. 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )
 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )| A. | 在正极发生的电极反应为:AgO+2e-+H2O=Ag+2OH- | |
| B. | 在正极区H+浓度增大,在负极区H+浓度减少 | |
| C. | 该电池总反应的化学方程式:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O | |
| D. | 当电池负极的质量变化10.8g,则过程中电池流动的电子物质的量为1.2NA |
19.下列有关Na2CO3和NaHCO3的叙述中,正确的是( )
| A. | 受热时,NaHCO3比Na2CO3容易分解 | |
| B. | NaHCO3俗名苏打,Na2CO3俗名纯碱 | |
| C. | NaHCO3溶液显酸性,Na2CO3溶液显碱性 | |
| D. | NaHCO3和Na2CO3各1mol分别与过量盐酸反应,产生CO2的质量不同 |
6.下列各反应中,生成物不随反应条件或反应物的用量变化而变化的是( )
| A. | 铁丝和氯气 | B. | NaOH和CO2 | C. | Fe和稀HNO3 | D. | Na和O2 |
3. 在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )
在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )
 在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )
在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则反应( )| A. | 正反应放热,L是固体 | B. | 正反应放热,L是气体 | ||
| C. | 正反应吸热,L是气体 | D. | 正反应吸热,L是固体 |
4.下列有关化学用语表示正确的是( )
| A. | 2016年命名的含有173个中子的113号元素:${\;}_{113}^{173}$Nh | |
| B. | 对硝基甲苯的结构简式: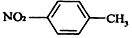 | |
| C. | CSO的电子式: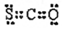 | |
| D. | F-的离子结构示意图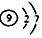 |