题目内容
6.下列各反应中,生成物不随反应条件或反应物的用量变化而变化的是( )| A. | 铁丝和氯气 | B. | NaOH和CO2 | C. | Fe和稀HNO3 | D. | Na和O2 |
分析 A、氯气具有强氧化性,铁和氯气反应只能生成氯化铁;
B、氢氧化钠和少量二氧化碳反应的产物是碳酸钠,和过量二氧化碳反应的产物是碳酸氢钠;
C、铁与足量稀硝酸反应生成硝酸铁,与少量稀硝酸反应生成硝酸亚铁;
D、Na和O2在常温下反应生成氧化钠,Na和O2在加热条件下反应生成氧化钠.
解答 解:A、氯气具有强氧化性,所以铁和氯气反应只能生成氯化铁,生成物不随反应条件或反应物的用量变化而变化,故A符合;
B、氢氧化钠与二氧化碳反应,二氧化碳不足时生成碳酸钠,二氧化碳过量时生成碳酸氢钠,反应物用量比改变,会引起产物的种类改变,故B不符合;
C、铁与足量稀硝酸反应生成硝酸铁,与少量稀硝酸反应生成硝酸亚铁,产物与稀硝酸用量有关,故C不符合;
D、Na和O2在常温下反应生成氧化钠,Na和O2在加热条件下反应生成氧化钠,反应条件改变,会引起产物的种类改变,故D不符合;
故选A.
点评 本题是对物质之间反应物量的不同导致的结果不同的考查,解题的关键是掌握具体的反应产物的不同,属于物质之间反应的探讨,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.某阳离子为钠离子的溶液中,可能含有SO42-、CO32-、Cl-的一种或几种,只取原溶液一次,便能一一检验其中存在的阴离子.下列加入试剂的顺序最合理的是( )
| A. | HNO3、Ba(NO3)2、AgNO3 | B. | Ba(NO3)2、AgNO3、HNO3 | ||
| C. | 酚酞、Ba(NO3)2、AgNO3 | D. | HCl、BaCl2、AgNO3 |
19.下列物质的性质和应用相对应的是( )
| 化学性质 | 实际应用 | |
| A | SiCl4与水反应时生成白色烟雾 | SiCl4在战争中可用作烟雾弹 |
| B | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| C | MgO是一种电解质 | 工业电解冶炼金属镁 |
| D | 铝耐腐蚀 | 用铝质容器研制咸菜 |
| A. | A | B. | B | C. | C | D. | D |
14.下列反应可用离子方程式“H++OH-=H2O”表示的是( )
| A. | H2SO4溶液与Ba(OH)2溶液混合 | B. | HCl与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与氨水混合 | D. | NaHCO3溶液与NaOH溶液混合 |
1.下列说法正确的是( )
| A. | 用分液漏斗分离除去溴苯中混入的溴 | |
| B. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| C. | 1mol葡萄糖可水解生成2mol乳酸(C3H6O3) | |
| D. | 结构简式为 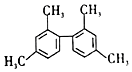 的分子中至少有11个碳原子处于同一平面上 的分子中至少有11个碳原子处于同一平面上 |
11.KMnO4和MnO2都是重要化学物质,在实验室可以做氧化剂和催化剂,某学习小组对两种物质的制备和性质探究如下:
I.MnO2的制备:
该学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其工艺流程如图:

请回答下列问题:
(1)第①步操作中,生成CO2的化学方程式为MnCO3+H2SO4=MnSO4+H2O+CO2↑.
(2)第②步操作中,NaClO3氧化MnSO4的离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
(3)第③步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的ad(填序号).
a.NaCl b.NaClO c.NaClO4 d.NaOH
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤.洗涤沉淀所用的玻璃仪器有:烧杯、漏斗、玻璃棒,判断是否洗涤干净可选用的试剂是BaCl2(填化学式).
(5)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等量的氯气消耗NaClO3与MnO2的物质的量之比为1:3.
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程的阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
II.KMnO4的制备和性质:
(7)实验室由二氧化锰制备高锰酸钾可分二步进行:
第一步:MnO2与KOH共熔并通入氧气:2MnO2+4KOH+O2=2K2MnO4+2H2O
第二步:通入CO2,可使K2MnO4发生歧化反应生成KMnO4和MnO2.
第二步完成反应时,转化为KMnO4的K2MnO4占其全部的百分率约为66.7%(精确到0.1%)
(8)该小组同学为了探究KMnO4溶液和Na2C2O4溶液的反应过程,将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如表:
下列说法中错误的是( )
①请将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+C2O42-+16H+=2Mn2++10CO2↑+8H2O
②请分析KMnO4溶液褪色时间变化的可能原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
I.MnO2的制备:
该学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其工艺流程如图:

请回答下列问题:
(1)第①步操作中,生成CO2的化学方程式为MnCO3+H2SO4=MnSO4+H2O+CO2↑.
(2)第②步操作中,NaClO3氧化MnSO4的离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+.
(3)第③步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的ad(填序号).
a.NaCl b.NaClO c.NaClO4 d.NaOH
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤.洗涤沉淀所用的玻璃仪器有:烧杯、漏斗、玻璃棒,判断是否洗涤干净可选用的试剂是BaCl2(填化学式).
(5)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等量的氯气消耗NaClO3与MnO2的物质的量之比为1:3.
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程的阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
II.KMnO4的制备和性质:
(7)实验室由二氧化锰制备高锰酸钾可分二步进行:
第一步:MnO2与KOH共熔并通入氧气:2MnO2+4KOH+O2=2K2MnO4+2H2O
第二步:通入CO2,可使K2MnO4发生歧化反应生成KMnO4和MnO2.
第二步完成反应时,转化为KMnO4的K2MnO4占其全部的百分率约为66.7%(精确到0.1%)
(8)该小组同学为了探究KMnO4溶液和Na2C2O4溶液的反应过程,将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如表:
| 起始加入量(mol) | 平衡时 | ||||
| A | B | C | A或C转化率(%) | C的物质的量分数(%) | 放出或吸收热量(KJ) |
| 1 | 1 | 0 | α1 | φ1 | Q1 |
| 0 | 0 | 2 | α2 | φ2 | Q2 |
| 2 | 2 | 0 | α2 | φ3 | Q3 |
①请将MnO4-氧化C2O42-的离子方程式补充完整:
2MnO4-+C2O42-+16H+=2Mn2++10CO2↑+8H2O
②请分析KMnO4溶液褪色时间变化的可能原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
15.下列有关铝的叙述错误的是( )
| A. | 铝制的容器可以贮存浓硫酸或浓硝酸 | |
| B. | 铝容易形成致密的氧化膜,抗腐蚀性能好 | |
| C. | 工业上电解氯化铝溶液可分解得到铝和氯气 | |
| D. | 工业上常用铝热反应进行焊接铁轨 |
16.NaOH标准溶液的配制和标定,需经过NaOH溶液配制,基准物质H2C2O4•2H2O的称量以及用NaOH溶液滴定等操作.下列有关说法正确的是( )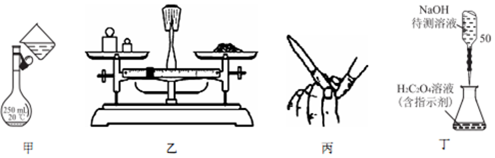

| A. | 用图甲所示操作转移NaOH 溶液到容量瓶中 | |
| B. | 用图乙所示装置准确称得0.1575gH2C2O4•2H2O固体 | |
| C. | 用图丙所示操作检查碱式滴定管是否漏液 | |
| D. | 用图丁所示装置以NaOH 待测液滴定H2C2O4溶液 |