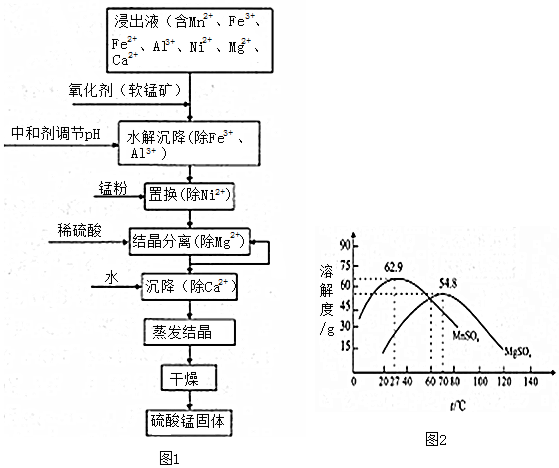
题目内容
4.下列有关化学用语表示正确的是( )| A. | 2016年命名的含有173个中子的113号元素:${\;}_{113}^{173}$Nh | |
| B. | 对硝基甲苯的结构简式: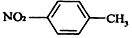 | |
| C. | CSO的电子式: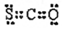 | |
| D. | F-的离子结构示意图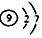 |
分析 A.113号元素质量数=质子数+中子数=113+173=286,原子符号中左上角为质量数,左下角为质子数;
B.对硝基甲苯中苯环连接氮原子;
C.CSO分子中含有一个碳氧双键和1个碳硫双键,各原子最外层都达到8电子稳定结构;
D.F为9号元素,核内有9个质子,带9个单位正电荷,氟离子核外10个电子,分别位于2个电子层上,最外层电子有8个.
解答 解:A.原子符号中左上角为质量数,左下角为质子数,2016年命名的含有173个中子的113号元素质量数为113+173=286,符号为$\underset{\stackrel{286}{\;}}{113}$Nh,故A错误;
B.对硝基甲苯中,硝基的N原子与苯环相连,正确的结构简式为: ,故B错误;
,故B错误;
C.CSO为共价化合物,碳原子分别与氧原子和硫原子生成了两对共用电子对,其电子式为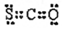 ,故C正确;
,故C正确;
D.F-为9号元素,原子核中有9个质子,带9个单位正电荷,核外10个电子,其离子结构示意图为 ,故D错误;
,故D错误;
故选C.
点评 本题考查了化学用语,主要是考查学生对常见化学用语的熟悉掌握程度,掌握微粒符号的意义、结构简式、电子式、原子结构示意图书写规范是解答关键,题目难度不大.

练习册系列答案
相关题目
14.下列反应可用离子方程式“H++OH-=H2O”表示的是( )
| A. | H2SO4溶液与Ba(OH)2溶液混合 | B. | HCl与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与氨水混合 | D. | NaHCO3溶液与NaOH溶液混合 |
15.下列有关铝的叙述错误的是( )
| A. | 铝制的容器可以贮存浓硫酸或浓硝酸 | |
| B. | 铝容易形成致密的氧化膜,抗腐蚀性能好 | |
| C. | 工业上电解氯化铝溶液可分解得到铝和氯气 | |
| D. | 工业上常用铝热反应进行焊接铁轨 |
12.在H2SO4、K2SO4、Al2(SO4)3和明矾的混合溶液中,H+的浓度为0.2mol/L,SO42-的浓度为0.5mol/L,当加入等体积0.6mol/L KOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+的浓度约为( )
| A. | 0.225mol/L | B. | 0.25mol/L | C. | 0.45mol/L | D. | 0.55mol/L |
9.下列离子方程式书写正确的是( )
| A. | C12与水反应:C12+H2O═2H++Cl-+ClO- | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Fe跟HCl溶液反应:Fe+2H+═Fe2++H2↑ | |
| D. | BaCO3与盐酸反应:CO32-+2 H+═H2O+CO2↑ |
16.NaOH标准溶液的配制和标定,需经过NaOH溶液配制,基准物质H2C2O4•2H2O的称量以及用NaOH溶液滴定等操作.下列有关说法正确的是( )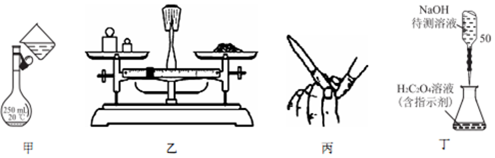

| A. | 用图甲所示操作转移NaOH 溶液到容量瓶中 | |
| B. | 用图乙所示装置准确称得0.1575gH2C2O4•2H2O固体 | |
| C. | 用图丙所示操作检查碱式滴定管是否漏液 | |
| D. | 用图丁所示装置以NaOH 待测液滴定H2C2O4溶液 |
13.下列试剂不能贮存在无色透明玻璃试剂瓶里的是( )
| A. | 硫酸铜溶液 | B. | NaOH溶液 | C. | 硝酸 | D. | 水玻璃 |
14.下列各组物质的性质比较中,正确的是( )
| A. | 稳定性:HCl>H2S>H2O | B. | 碱性:NaOH>KOH>Mg(OH)2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 还原性:I-<Br-<Cl- |