题目内容
6.Mg-AgCl 电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg═Mg2++2Ag+2Cl-.有关该电池的说法正确的是( )| A. | Mg 为电池的正极 | |
| B. | 负极反应为 AgCl+e-=Ag+Cl- | |
| C. | 可用于海上应急照明供电 | |
| D. | 电池工作时,电解质溶液质量不断减轻 |
分析 电池反应方程式为:2AgCl+Mg═Mg2++2Ag+2Cl-.Mg失去电子作负极,正极上Ag得到电子,为一次性贮备电池,且Mg、Cl均转化为离子存在于海水中,以此来解答.
解答 解:A.Mg失去电子作负极,故A错误;
B.正极反应为AgCl+e-=Ag+Cl-,故B错误;
C.Mg-AgCl 电池是一种能被海水激活的一次性贮备电池,可用于海上应急照明供电,故C正确;
D.电池工作时,Mg、Cl均转化为离子存在于海水中,电解质溶液质量不断增加,故D错误;
故选C.
点评 本题考查化学电源新型电池,为高频考点,把握电池反应、电极反应为解答的关键,侧重分析与应用能力的考查,注意电池反应与氧化还原反应的关系,题目难度不大.

练习册系列答案
相关题目
17.“可呼吸”钠-二氧化碳电池的工作原理为4Na+3CO2$?_{充电}^{放电}$2Na2CO3+C.下列叙述错误的是( )
| A. | 放电时,Na+由负极向正极移动 | |
| B. | 充电时,阴极反应式为Na++e-═Na | |
| C. | 电解质溶液可选NaClO4水溶液 | |
| D. | 电池放电时把二氧化碳变废为宝,有重要的研发意义 |
14.下列实验操作、现象与结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将过量SO2通入BaCl2溶液中 | 先有白色沉淀生成,后沉淀消失 | 最终生成Ba(HSO3)2 |
| B | 将Cl2通入石蕊试液中 | 先变红后褪色 | Cl2有漂白性 |
| C | 将氨气通入到盛有氯化铝的溶液中 | 先生成白色沉淀,后白色沉淀消失 | 氨水能与氢氧化铝反应 |
| D | 将少量溴水滴加到KI溶液中,再加入CCl4振荡、静置 | 溶液分层,上层无色,下层紫红色 | 氧化性:Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
1.已知:25℃时,电离常数Kb(NH3•H2O)=1.8×10-5,CH3COOH的电离常数与其相等.现向1L 0.1mol•L-1氨水中加入等体积的0.1mol•L-1CH3COOH溶液,则下列说法正确的是( )
| A. | 在滴加过程中,Kw始终保持不变 | |
| B. | 25℃时,反应后溶液中c(NH4+)>c(CH3COO-) | |
| C. | 若用氨水标准溶液滴定盐酸,则应选择酚酞作为指示剂 | |
| D. | 25℃时,反应NH4++H2O?NH3•H2O+H+的平衡常数约为5.6×10-10 |
11.某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证哪位同学的判断正确,丙同学设计了如图1所示实验装置(锌与浓硫酸共热时产生的气体为X,气体发生装置略去).试回答:
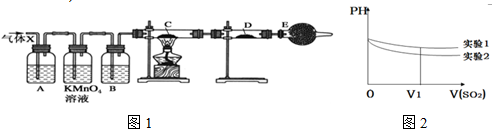
(1)上述反应中生成二氧化硫的化学方程式为Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O.
(2)乙同学认为还可能产生氢气的理由是在Zn与浓H2SO4反应过程中,H2SO4被消耗且有水生成,H2SO4浓度逐渐减小,变成稀硫酸,Zn与稀H2SO4反应生成H2.
(3)A中加入的试剂可能是品红溶液,作用是检验SO2;B中加入的试剂可能是浓H2SO4,作用是吸收水蒸气;
(4)可以证明气体X中含有氢气的实验现象是:C中:黑色(CuO)粉末变成红色(Cu),D中:白色粉末变成蓝色.
(5)II.该小组同学将收集的SO2气体通入0.1mol•L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
该小组设计实验验证了假设一,
(5)请在下表空白处填写相关实验现象
(6)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图2,实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3,亚硫酸显酸性,故pH值减小V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)3SO2+2H2O+2NO3- 2NO+4H++3SO42-;.
2NO+4H++3SO42-;.

(1)上述反应中生成二氧化硫的化学方程式为Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O.
(2)乙同学认为还可能产生氢气的理由是在Zn与浓H2SO4反应过程中,H2SO4被消耗且有水生成,H2SO4浓度逐渐减小,变成稀硫酸,Zn与稀H2SO4反应生成H2.
(3)A中加入的试剂可能是品红溶液,作用是检验SO2;B中加入的试剂可能是浓H2SO4,作用是吸收水蒸气;
(4)可以证明气体X中含有氢气的实验现象是:C中:黑色(CuO)粉末变成红色(Cu),D中:白色粉末变成蓝色.
(5)II.该小组同学将收集的SO2气体通入0.1mol•L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
该小组设计实验验证了假设一,
(5)请在下表空白处填写相关实验现象
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
 2NO+4H++3SO42-;.
2NO+4H++3SO42-;.
18.某阳离子为钠离子的溶液中,可能含有SO42-、CO32-、Cl-的一种或几种,只取原溶液一次,便能一一检验其中存在的阴离子.下列加入试剂的顺序最合理的是( )
| A. | HNO3、Ba(NO3)2、AgNO3 | B. | Ba(NO3)2、AgNO3、HNO3 | ||
| C. | 酚酞、Ba(NO3)2、AgNO3 | D. | HCl、BaCl2、AgNO3 |
15.(CH3)2C(C2H5)CH(CH3)2的名称是( )
| A. | 2,3,3-三甲基戊烷 | B. | 3,3,4-三甲基戊烷 | ||
| C. | 2,3-二甲基-2-乙基丁烷 | D. | 2,3-二甲基-3-乙基丁烷 |
14.下列反应可用离子方程式“H++OH-=H2O”表示的是( )
| A. | H2SO4溶液与Ba(OH)2溶液混合 | B. | HCl与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与氨水混合 | D. | NaHCO3溶液与NaOH溶液混合 |