题目内容
20.有机物PAS-Na是一种治疗肺结核药物的有效成分,有机物G是一种食用香料,以甲苯为原料合成这两种物质的路线如图: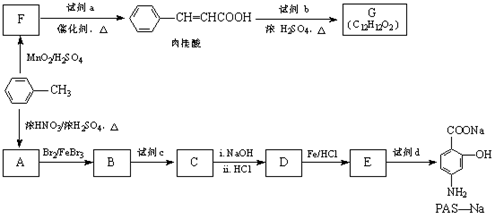
已知:
①
 (R-CH3或-H)
(R-CH3或-H)②
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
③
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
回答下列问题:
(1)
 生成A的反应类型是取代反应.
生成A的反应类型是取代反应.(2)F中含氧官能团的名称是醛基;试剂a的结构简式为
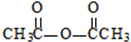 .
.(3)写出由A生成B的化学方程式:
 .
.(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式:.

(5)当试剂d过量时,可以选用的试剂d是a(填字母序号).
a.NaHCO3b.NaOH c.Na2CO3
(6)写出C与足量NaOH在一定条件反应的化学方程式
 .(不用写条件)
.(不用写条件)(7)肉桂酸有多种同分异构体,符合下列条件的有6种.
a.苯环上有三个取代基;
b.能发生银镜反应,且1mol该有机物最多生成4molAg.
由上述符合条件的同分异构体中,写出苯环上有两种不同化学环境氢原子的有机物的结构简式
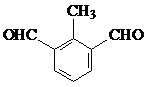 或
或  (任写一种即可).
(任写一种即可).
分析 F生成肉桂酸发生信息①的反应,所以可推知甲苯在MnO2/H2SO4条件下氧化为F为 ,则a为
,则a为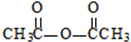 ,根据肉桂酸与G的分子式可知,肉桂酸和试剂b反应酯化反应生成G,试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,则可判断b为CH2=CHCH2OH,则G为
,根据肉桂酸与G的分子式可知,肉桂酸和试剂b反应酯化反应生成G,试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,则可判断b为CH2=CHCH2OH,则G为 ,甲苯和浓硝酸发生硝化反应生成A,根据PAS-Na的结构简式可推断A为
,甲苯和浓硝酸发生硝化反应生成A,根据PAS-Na的结构简式可推断A为 ,
, 和Br2在甲基邻位引入Br原子得到B为
和Br2在甲基邻位引入Br原子得到B为 ,B被酸性高锰酸钾氧化成C为
,B被酸性高锰酸钾氧化成C为 ,则试剂c为酸性高锰酸钾溶液,将甲基氧化为羧基得C,C碱性条件下水解后,再酸化得D为
,则试剂c为酸性高锰酸钾溶液,将甲基氧化为羧基得C,C碱性条件下水解后,再酸化得D为 ,D中硝基被还原为氨基得E为
,D中硝基被还原为氨基得E为 ,E和碳酸氢钠反应得PAS-Na.
,E和碳酸氢钠反应得PAS-Na.
解答 解:F生成肉桂酸发生信息①的反应,所以可推知甲苯在MnO2/H2SO4条件下氧化为F为 ,则a为
,则a为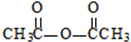 ,根据肉桂酸与G的分子式可知,肉桂酸和试剂b反应酯化反应生成G,试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,则可判断b为CH2=CHCH2OH,则G为
,根据肉桂酸与G的分子式可知,肉桂酸和试剂b反应酯化反应生成G,试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,则可判断b为CH2=CHCH2OH,则G为 ,甲苯和浓硝酸发生硝化反应生成A,根据PAS-Na的结构简式可推断A为
,甲苯和浓硝酸发生硝化反应生成A,根据PAS-Na的结构简式可推断A为 ,
, 和Br2在甲基邻位引入Br原子得到B为
和Br2在甲基邻位引入Br原子得到B为 ,B被酸性高锰酸钾氧化成C为
,B被酸性高锰酸钾氧化成C为 ,则试剂c为酸性高锰酸钾溶液,将甲基氧化为羧基得C,C碱性条件下水解后,再酸化得D为
,则试剂c为酸性高锰酸钾溶液,将甲基氧化为羧基得C,C碱性条件下水解后,再酸化得D为 ,D中硝基被还原为氨基得E为
,D中硝基被还原为氨基得E为 ,E和碳酸氢钠反应得PAS-Na.
,E和碳酸氢钠反应得PAS-Na.
(1)甲苯发生取代反应生成 ,
,
故答案为:取代反应;
(2)F为 ,含氧官能团为醛基,试剂a的结构简式为:
,含氧官能团为醛基,试剂a的结构简式为: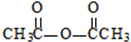 ,
,
故答案为:醛基;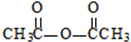 ;
;
(3)由A生成B的化学方程式为: ,
,
故答案为: ;
;
(4)G为 ,b为CH2=CHCH2OH,肉桂酸与试剂b生成G的化学方程式为:
,b为CH2=CHCH2OH,肉桂酸与试剂b生成G的化学方程式为: ,
,
故答案为: ;
;
(5)试剂d可以将羧基转化为其钠盐,而不能和酚羟基反应,一定是NaHCO3,酚羟基能与氢氧化钠、碳酸钠反应,
故选:a;
(6)C为 ,C中含有羧基和溴原子,所以和氢氧化钠溶液水解、中和的方程式为:
,C中含有羧基和溴原子,所以和氢氧化钠溶液水解、中和的方程式为: ,
,
故答案为: ;
;
(7)肉桂酸的同分异构体,能发生银镜反应,且1mol该有机物最多生成4mol Ag,说明含有2个醛基,又苯环上有三个取代基,所以连有两个醛基和一个甲基,两个醛基有邻、间、对3种位置,对应的甲基分别有2种、3种、1种位置,故符合条件的同分异构体共有6种,苯环上有两种不同化学环境氢原子的有机物的结构简式为 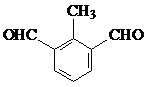

故答案为:6;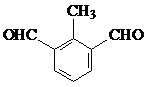

点评 本题考查有机物推断与合成,侧重考查学生分析推理及知识迁移能力,根据有机物的结构、反应条件、结合题给信息进行推断,熟练掌握官能团的性质与转化.

(1)三氮化铵水解可生成氨气和物质X,X的结构式为
 .
.(2)已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,断裂1mol N≡N键需要的能量为946kJ.

(3)常温下,向amol•L-1的氨水加入等体积bmol•L-1的盐酸,混合溶液呈中性,则该温度下氨水的电离平衡常数为$\frac{b×1{0}^{-7}}{a-b}$(用含a和b的代数式表示).
(4)相同温度下,向甲、乙、丙三个容积相同的恒容密闭容器中按照下列三种方式分别投料,发生反应:N2(g)+3H2(g)?2NH3(g),测得甲容器中H2的平衡转化率为40%.
| N(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
②达到平衡时,甲、乙、丙三个容器中NH3的体积分数由大到小的顺序为丙>甲=乙.
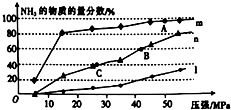
(5)现分别在150℃、300℃、500℃时向反应器中接n(N2):n(H2)=1:3投料发反应:N2(g)+3H2(g)?2NH3(g),该反应达到平衡时,体系中NH3的物质的量分数随压强的变化曲线如图所示.
①150℃时发生的反应可用曲线m(填“m”、“n”或“l”)表示.
②上图中A、B、C三点的平衡常数K的大小关系是K(B)=K(C)<K(A).
③若B点时c(NH3)=0.6mol•L-1,则此时反应的化学平衡常数K=44.4.
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
(1)D的元素名称是磷,若H的一种同位素中子数为5,则其原子符号是${\;}_{5}^{10}$B,B元素的原子结构示意图是
 ;
;(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物F2A2的电子式是:
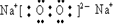 .
.(3)用电子式表示F2I的形成过程:
 ;
;(4)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则乙极的电极反应式为:O2+4e-+2H2O=4OH-.
| A. | 元素的非金属性顺序为R>Y>W | |
| B. | R与其他三种元素均能形成共价化合物 | |
| C. | 简单氢化物的热稳定性顺序为R>W>Y | |
| D. | 原子半径次序为W>R>X>Y |
| A. | O | B. | F | C. | S | D. | Cl |
 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.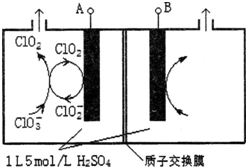 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.