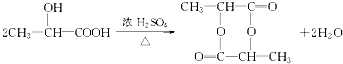题目内容
9.在下列元素中,其非金属性最强的元素是( )| A. | O | B. | F | C. | S | D. | Cl |
分析 同一周期元素,元素的非金属性随着原子序数增大而增强,同一主族元素,元素的非金属性随着原子序数增大而减弱,据此分析解答.
解答 解:同一周期元素,元素的非金属性随着原子序数增大而增强,所以非金属性F>0、Cl>S,同一主族元素,元素的非金属性随着原子序数增大而减弱,所以非金属性F>Cl、O>S,则非金属性最强的是F元素,故选B.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素原子结构和元素周期律关系是解本题关键,知道非金属性强弱与得电子难易程度有关,与得电子多少无关,会正确判断非金属性强弱,题目难度不大.

练习册系列答案
相关题目
14.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| C. | 含4.8g碳元素的石墨晶体中的共价键数为1.2NA个 | |
| D. | 2mL 0.5mol/L硅酸钠溶液中滴入过量盐酸制备硅酸胶体,所得胶粒数目为0.001NA |
1.硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同.气体成分可能含SO2、SO3和O2中的一种、两种或三种.某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式.实验用到的仪器如图所示:
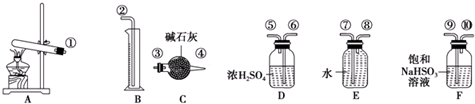
【提出猜想】
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有SO2、O2两种;
Ⅲ.所得气体的成分可能含有SO3、SO2、O2三种.
【实验探究】
实验操作过程略.
已知实验结束时,硫酸铜完全分解.
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为:①→⑨→⑩→⑥→⑤→③→④→⑧→⑦→②(填接口序号).
(2)若实验结束时B中量筒没有收集到水,则证明猜想Ⅰ正确.
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式.
第一小组:2CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2↑+O2↑;
第二小组:4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO2↑+2SO3↑+O2↑.

【提出猜想】
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有SO2、O2两种;
Ⅲ.所得气体的成分可能含有SO3、SO2、O2三种.
【实验探究】
实验操作过程略.
已知实验结束时,硫酸铜完全分解.
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为:①→⑨→⑩→⑥→⑤→③→④→⑧→⑦→②(填接口序号).
(2)若实验结束时B中量筒没有收集到水,则证明猜想Ⅰ正确.
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
| 实验小组 | 称取CuSO4的质量/g | 装置C增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 2.56 | 224 |
第一小组:2CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2↑+O2↑;
第二小组:4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO2↑+2SO3↑+O2↑.
18. 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
(1)氮气性质稳定,可用作保护气.请用电子式表示氮气的形成过程: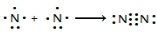 .
.
(2)联氨(N2H4)是一种还原剂.已知:H2O(l)═H2O(g)△H=+44kJ/mol.试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol.
(3)KCN可用于溶解难溶金属卤化物.将AgI溶于KCN溶液中,形成稳定的Ag(CN)2-,该转化的离子方程式为:AgI(s)+2CN-(aq)Ag(CN)2-(aq)+I-(aq).若已知Ksp(AgI)=1.5×10-16,K稳[Ag(CN)2-]=1.0×1021,则上述转化方程式的平衡常数K=1.5×105.(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸.该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:NH3-5e-+5OH-=NO+4H2O.
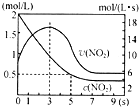
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2?N2O4其相关图象如图.
①0~3s时v(NO2)增大的原因是容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大.
②5s时NO2转化率为75%.
 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:(1)氮气性质稳定,可用作保护气.请用电子式表示氮气的形成过程:
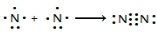 .
.(2)联氨(N2H4)是一种还原剂.已知:H2O(l)═H2O(g)△H=+44kJ/mol.试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol.
| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(4)氨的催化氧化用于工业生产硝酸.该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:NH3-5e-+5OH-=NO+4H2O.
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2?N2O4其相关图象如图.
①0~3s时v(NO2)增大的原因是容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大.
②5s时NO2转化率为75%.
19.下列叙述中,指定粒子的数目约为6.02×1023的是( )
| A. | 1.6gCH4中含有的分子数 | |
| B. | 100 mL1mol/LH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下,22.4LCO气体中含有的分子数 |

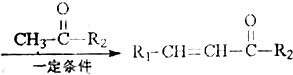 +H2O
+H2O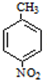 ;反应②的反应类型取代反应.
;反应②的反应类型取代反应.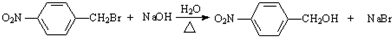 .
.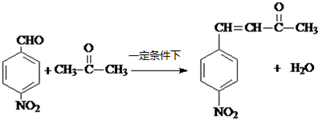 .
.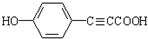 .
.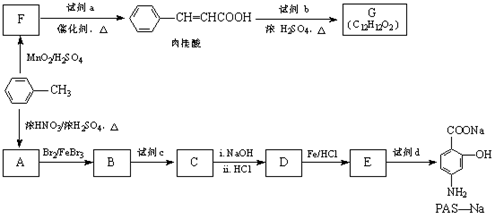
 (R-CH3或-H)
(R-CH3或-H) $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
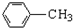 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$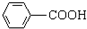
 生成A的反应类型是取代反应.
生成A的反应类型是取代反应.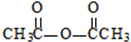 .
. .
.
 .(不用写条件)
.(不用写条件)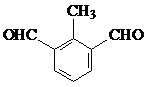 或
或  (任写一种即可).
(任写一种即可).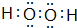 .
.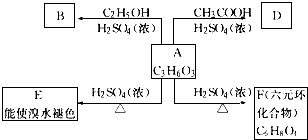
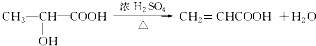 ;A→F
;A→F