题目内容
8. 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为5ClO2-+4H+=4ClO2↑+Cl-+2H2O.向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快.产生气体速率迅速加快的原因是反应生成的氯离子对该反应起催化作用.
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2.用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2.
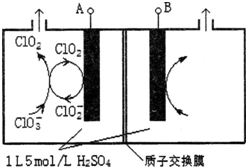
(3)电解法是目前研究最为热门的生产ClO2的方法之一.如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验.
①电源负极为A极(填A或B)
②写出阴极室发生反应依次为ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2-歧化反应.若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为0.8mol/L.
分析 1)反应物为亚氯酸钠,所在环境为酸性环境,生成物为ClO2气体,且知此反应为歧化反应,据此书写离子反应方程式即可;改加pH相同的硫酸,氢离子浓度不变,应考虑氯离子的影响;
(2)H2O2作还原剂时氧化产物为O2,不会产生环境污染;
(3)①与电源负极相连的一极为阳极,溶液中的阳离子在此电极得到电子,发生还原反应;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2;
③电解池中阴极得到的电子数等于阳极失去的电子数,根据阳极室发生反应:4OH--4e-=O2↑+2H2O,阴极发生:ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O,结合电极方程式计算.
解答 解:(1)亚氯酸钠在强酸性溶液中会发生歧化反应,产生ClO2气体,故化合价由+3价升高到+4价,故部分氯离子降低为-1价,离子反应方程式为:5ClO2-+4H+=4ClO2↑+Cl-+2H2O,反应开始时,溶液中氯离子浓度很小,随着反应的进行,溶液中氯离子浓度增大,反应速率加快,可见氯离子起催化作用,
故答案为:5ClO2-+4H+=4ClO2↑+Cl-+2H2O;反应生成的氯离子对该反应起催化作用;
(2)还可采用盐酸或双氧水还原氯酸钠制备ClO2.用H2O2作还原剂制备ClO2更受欢迎,其主要原因是H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2,不会产生环境污染,
故答案为:H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2;
(3)①由图可知,ClO2在电极A上得到1个电子,生成ClO2-,故A应为电源的负极,故答案为:A;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2,离子反应方程式为:ClO3-+ClO2-+2H+=2ClO2↑+H2O,
故答案为:ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O;
③在电解池的整个闭合回路中阴极得到的电子数等于阳极失去的电子数,在阳极室发生反应:4OH--4e-=O2↑+2H2O产生1mol的O2,转移4mold电子,阴极室ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O每产生4mol的ClO2电子转移4mol电子,共产生气体5mol.现在两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),产生气体的物质的量为1mol,所以转移电子0.8mol,在阳极有0.8mol的OH--离子放电.因为溶液的体积为1L,所以此时阳极室与阴极室c(H+)之差为0.8mol/L,
故答案为:0.8mol/L.
点评 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.

 名校课堂系列答案
名校课堂系列答案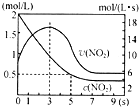 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:(1)氮气性质稳定,可用作保护气.请用电子式表示氮气的形成过程:
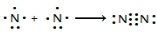 .
.(2)联氨(N2H4)是一种还原剂.已知:H2O(l)═H2O(g)△H=+44kJ/mol.试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol.
| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(4)氨的催化氧化用于工业生产硝酸.该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:NH3-5e-+5OH-=NO+4H2O.
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2?N2O4其相关图象如图.
①0~3s时v(NO2)增大的原因是容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大.
②5s时NO2转化率为75%.

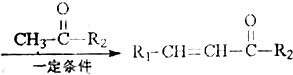 +H2O
+H2O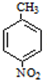 ;反应②的反应类型取代反应.
;反应②的反应类型取代反应.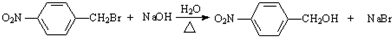 .
. .
. .
.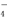 =5SO2-4+2Mn2+ +3H2O
=5SO2-4+2Mn2+ +3H2O 二氧化氯(ClO2)是一种高效消毒剂,在60℃时用氯酸钾与草酸(中强酸)反应可制备二氧化氯,实验装置如图所示.已知:通常情况下,二氧化氯的沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质确定的气体稀释,以防爆炸,回答下列问题:
二氧化氯(ClO2)是一种高效消毒剂,在60℃时用氯酸钾与草酸(中强酸)反应可制备二氧化氯,实验装置如图所示.已知:通常情况下,二氧化氯的沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质确定的气体稀释,以防爆炸,回答下列问题:
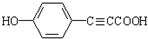
 (R-CH3或-H)
(R-CH3或-H) $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$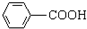
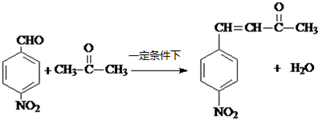
 生成A的反应类型是取代反应.
生成A的反应类型是取代反应.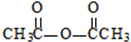 .
. .
.
 .(不用写条件)
.(不用写条件)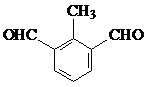 或
或  (任写一种即可).
(任写一种即可).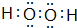 .
.