��Ŀ����
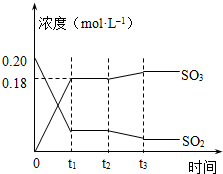 ��֪2SO2 ��g��+O2��g��?2SO3��g����H=-196kJ?mol-1��5000Cʱ��2mol SO2��1molO2װ��һ����㶨��10L�ܱ������У�2���ӣ�t1��ʱ�ﵽƽ�⣮��ͼ��ʾ��
��֪2SO2 ��g��+O2��g��?2SO3��g����H=-196kJ?mol-1��5000Cʱ��2mol SO2��1molO2װ��һ����㶨��10L�ܱ������У�2���ӣ�t1��ʱ�ﵽƽ�⣮��ͼ��ʾ����ش��������⣺
��1����O2��ʾ2�����ڸ÷�Ӧ��ƽ����Ӧ����Ϊ
��2����ͼ��ʾ�÷�Ӧ��ʱ��t1�ﵽƽ���ʱ��t2��ı�ij�������������仯�������ͼ��ʱ��t2�����ı������������
��3����������������ʼװ���SO2��O2��2mol����ƽ�����SO2��ת����Ϊx���г���x�ķ���
��4��ij�¶�ʱ���÷�Ӧ��ƽ�ⳣ��K=800������¶�
��5��500��ʱ������ʼװ���SO2��O2��SO3�ֱ�Ϊ0.2mol��y mol��wmol���ﵽƽ��ʱ����ֵĺ�����ڣ�3����ȫ��ͬ����y=
���㣺���ʵ�����Ũ����ʱ��ı仯����,��ѧƽ��ļ���
ר�⣺��ѧƽ��ר��
��������1������v=
���㷴Ӧ���ʣ�����K=
����ƽ�ⳣ����
��2��t2��t3ʱ�̣���ѧƽ��������Ӧ�����ƶ�����ϸÿ��淴Ӧ�ͻ�ѧƽ���ƶ���Ӱ�������жϣ�
��3����x��ʾ��ƽ��ʱSO3��SO2��O2��Ũ�ȣ����뻯ѧƽ�ⳣ������ʽ��ʽ�ó���
��5���ﵽƽ��ʱ����ֵĺ�����ڣ�3����ȫ��ͬ����������ѧƽ���Ч�����ڷ�Ӧǰ�����������ͬ����ת��Ϊ��Ӧ��ʱ���루3�����뷴Ӧ�����ʵ�����ͬ������ü������������µ�Ũ���̣��뻯ѧƽ�ⳣ���Ƚϣ��ж��ƶ�����
| ��c |
| ��t |
| c2(SO3) |
| c2(SO2)?c(O2) |
��2��t2��t3ʱ�̣���ѧƽ��������Ӧ�����ƶ�����ϸÿ��淴Ӧ�ͻ�ѧƽ���ƶ���Ӱ�������жϣ�
��3����x��ʾ��ƽ��ʱSO3��SO2��O2��Ũ�ȣ����뻯ѧƽ�ⳣ������ʽ��ʽ�ó���
���
�⣺��1��2SO2 ��g��+O2��g��?2SO3��g��
��ʼ 0.2mol/L 0.1mol/L 0mol/L
�仯 0.18mol/L 0.09mol/L 0.18mol/L
ƽ��ʱ 0.02mol/L 0.01mol/L 0.18mol/L
2�����ڣ���O2��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ
=0.045mol?L-1?min-1��500��ʱ���÷�Ӧ��ƽ�ⳣ��K=
=
=8.1��103��mol?L-1��-1
�ʴ�Ϊ��0.045mol?L-1?min-1��8.1��103��mol?L-1��-1��
��2��t2��t3ʱ�̣���ѧƽ��������Ӧ�����ƶ�����SO2��SO3Ũ�Ȳ��䣬����ͨ�����»�����O2��Ũ�ȴﵽĿ�ģ�
�ʴ�Ϊ�����»�����O2��Ũ�ȣ�
��3��2SO2 ��g��+O2��g��?2SO3��g��
��ʼ 0.2mol/L 0.1mol/L 0mol/L
�仯 0.2xmol/L 0.1xmol/L 0.2xmol/L
2����ʱ �� 0.2-0.2x��mol/L ��0.1-0.1x��mol/L 0.2xmol/L
����K=
=8100��
�ʴ�Ϊ��
=8100��
��4��K=800С��8.1��103��ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ�����淴ӦΪ���ȷ�Ӧ�������¶������ȷ�����У����¶ȸ���500�棬
�ʴ�Ϊ������
��5��2SO2 ��g��+O2��g��?2SO3��g��
��ʼ��0.2mol ymol wmol
ת����wmol
mol wmol
ת����0.2+w��mol ��y+
��mol 0mol
�루3����Ч����0.2+w��=2mol��w=1.8mol����y+
��mol=2mol��y=1.1mol��
�տ�ʼʱ��������Ũ��Ϊ��c��SO2��=
=0.02mol/L��c��SO3��=
=0.18mol/L��c��O2��=
=0.11mol/L��
Ũ����Q=
=736��С�ڻ�ѧƽ�ⳣ��8100��Ӧ������Ӧ�����ƶ���
�ʴ�Ϊ��1.1������
��ʼ 0.2mol/L 0.1mol/L 0mol/L
�仯 0.18mol/L 0.09mol/L 0.18mol/L
ƽ��ʱ 0.02mol/L 0.01mol/L 0.18mol/L
2�����ڣ���O2��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ
| 0.09mol/L |
| 2min |
| c2(SO3) |
| c2(SO2)?c(O2) |
| (0.18mol/L)2 |
| (0.02mol/L)2?0.01mol/L |
�ʴ�Ϊ��0.045mol?L-1?min-1��8.1��103��mol?L-1��-1��
��2��t2��t3ʱ�̣���ѧƽ��������Ӧ�����ƶ�����SO2��SO3Ũ�Ȳ��䣬����ͨ�����»�����O2��Ũ�ȴﵽĿ�ģ�
�ʴ�Ϊ�����»�����O2��Ũ�ȣ�
��3��2SO2 ��g��+O2��g��?2SO3��g��
��ʼ 0.2mol/L 0.1mol/L 0mol/L
�仯 0.2xmol/L 0.1xmol/L 0.2xmol/L
2����ʱ �� 0.2-0.2x��mol/L ��0.1-0.1x��mol/L 0.2xmol/L
����K=
| (0.2x)2 |
| (0.2-0.2x)2?(0.1-0.1x) |
�ʴ�Ϊ��
| (0.2x)2 |
| (0.2-0.2x)2?(0.1-0.1x) |
��4��K=800С��8.1��103��ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ�����淴ӦΪ���ȷ�Ӧ�������¶������ȷ�����У����¶ȸ���500�棬
�ʴ�Ϊ������
��5��2SO2 ��g��+O2��g��?2SO3��g��
��ʼ��0.2mol ymol wmol
ת����wmol
| w |
| 2 |
ת����0.2+w��mol ��y+
| w |
| 2 |
�루3����Ч����0.2+w��=2mol��w=1.8mol����y+
| w |
| 2 |
�տ�ʼʱ��������Ũ��Ϊ��c��SO2��=
| 0.2mol |
| 10L |
| 1.8mol |
| 10L |
| 1.1mol |
| 10L |
Ũ����Q=
| 0.182 |
| 0.022?0.11 |
�ʴ�Ϊ��1.1������
����������ƽ�ⳣ���ļ��㣬���鷽��ʽ��д����Ӧ���ʼ��㡢��Чƽ��ȣ��Ѷ����У�������߿�����Ƶ�ʽϸߣ�ƽʱѧϰҪ����ע�⣮

��ϰ��ϵ�д�
 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д�
�����Ŀ
���г����ʣ�����������Ϊ���ʣ��ķ�����ȷ���� ��������
| A���������������ᣩ������NaOH��Һ���ȣ���Һ |
| B���������ӣ�����ˮ������ |
| C���������֣����ᣩ������Na2CO3��Һ����Һ |
| D���������ӣ�������NaOH��Һ����Һ |
��һ���¶��£���Ӧ
H2��g��+
X2��g��?HX��g����ƽ�ⳣ��Ϊ10������1.0mol��HX��g��ͨ�����Ϊ1.0L���ܱ������У��ڸ��¶�ʱHX��g�������ֽ���Ϊ��������
| 1 |
| 2 |
| 1 |
| 2 |
| A��9.1% | B��10.0% |
| C��28.6% | D��71.5% |
 ��1��ˮ�ĵ���ƽ��������ͼ��ʾ������A���ʾ25��ʱˮ�ڵ���ƽ��ʱ������Ũ�ȣ����¶�����100��ʱ��ˮ�ĵ���ƽ��״̬��B�㣬���ʱˮ�����ӻ���
��1��ˮ�ĵ���ƽ��������ͼ��ʾ������A���ʾ25��ʱˮ�ڵ���ƽ��ʱ������Ũ�ȣ����¶�����100��ʱ��ˮ�ĵ���ƽ��״̬��B�㣬���ʱˮ�����ӻ���
