题目内容
将2mol SO2和1mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0 当反应进行到时间t0点时达到平衡状态,测得混合气体的总物质的量为2.1mol.
试回答:
(1)该反应的平衡常数表达式: .
(2)反应进行到t0时SO2的体积分数 .
(3)当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度为T2 (T2>T1),反应在t2 时间时(t2>t1)重新达到平衡状 态,新平衡混合物中气体的总物质的量 2.1mol(填“<”、“>”或“=”).
试回答:
(1)该反应的平衡常数表达式:
(2)反应进行到t0时SO2的体积分数
(3)当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度为T2 (T2>T1),反应在t2 时间时(t2>t1)重新达到平衡状 态,新平衡混合物中气体的总物质的量
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)根据化学平衡常数表达式的概念,结合2SO2(g)+O2(g)?2SO3(g)△H<0,列出平衡常数表达式;
(2)根据化学平衡计算,结合题中的条件,先求出平衡状态时SO2、O2、SO3平衡量,再根据同温同压下,体积比等于物质的量之比解决;
(3)根据2SO2(g)+O2(g)?2SO3(g)△H<0,可知温度升高时,反应向逆反应方向移动,由于升高温度平衡向逆反应方向移动,逆反应方向是气体物质的量增多的方向,故新平衡混合物中气体的总物质的量增多.
(2)根据化学平衡计算,结合题中的条件,先求出平衡状态时SO2、O2、SO3平衡量,再根据同温同压下,体积比等于物质的量之比解决;
(3)根据2SO2(g)+O2(g)?2SO3(g)△H<0,可知温度升高时,反应向逆反应方向移动,由于升高温度平衡向逆反应方向移动,逆反应方向是气体物质的量增多的方向,故新平衡混合物中气体的总物质的量增多.
解答:
解:(1)有反应2SO2(g)+O2(g)?2SO3(g)△H<0,根据平衡常数表达式的概念,此反应的平衡常数表达式为K=
;
故答案为:
;
(2)设反应达到平衡时,有xmol的SO2发生反应,根据
2SO2(g)+O2(g)?2SO3(g)
起始物质的量(mol) 2 1 0
转化物质的量(mol) x
x
平衡物质的量(mol) (2-x) (1-
) x
则根据题中的条件得:(2-x)+(1-
)+x=2.1
解得:x=1.8
t0时SO2的体积分数为:
×100%=9.52%,
故答案为:9.52%;
(4)由于反应2SO2(g)+O2(g)?2SO3(g)△H<0,温度升高,反应向逆反应方向移动,气体的总物质的量增加,原平衡时,混合气体的总物质的量为2.1mol,所以再次达到平衡时,气体的总物质的量大于2.1mol,
故答案为:>.
| c2(SO3) |
| c2(SO2)c(O2) |
故答案为:
| c2(SO3) |
| c2(SO2)c(O2) |
(2)设反应达到平衡时,有xmol的SO2发生反应,根据
2SO2(g)+O2(g)?2SO3(g)
起始物质的量(mol) 2 1 0
转化物质的量(mol) x
| x |
| 2 |
平衡物质的量(mol) (2-x) (1-
| x |
| 2 |
则根据题中的条件得:(2-x)+(1-
| x |
| 2 |
解得:x=1.8
t0时SO2的体积分数为:
| 0.2mol |
| 2.1mol |
故答案为:9.52%;
(4)由于反应2SO2(g)+O2(g)?2SO3(g)△H<0,温度升高,反应向逆反应方向移动,气体的总物质的量增加,原平衡时,混合气体的总物质的量为2.1mol,所以再次达到平衡时,气体的总物质的量大于2.1mol,
故答案为:>.
点评:本题系统考查了化学平衡部分的平衡常数表达式、平衡的移动、化学平衡的计算等知识,关键把握住化学平衡移动原理对平衡移动的分析,题目难度中等.

练习册系列答案
相关题目
下列判断错误的是( )
| A、稳定性:H2O>H2S>H2Se |
| B、熔点:SiO2>NaCl>I2>CO2 |
| C、酸性:HCl>HBr>HI |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
科学家预言:“水不久将成为一个深刻的社会危机.”这是因为( )
| A、地球上水很少,不能满足人类的需要 |
| B、土地沙漠化,使空气中水蒸气不断减少 |
| C、由于地球表面气温的作用,水会被不断蒸发掉 |
| D、淡水资源不充足,分布又很不均匀,而且人类活动使水不断地受到污染,使淡水资源越来越紧缺 |


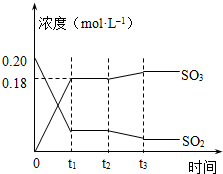 已知2SO2 (g)+O2(g)?2SO3(g)△H=-196kJ?mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡.如图所示:
已知2SO2 (g)+O2(g)?2SO3(g)△H=-196kJ?mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡.如图所示: