题目内容
在一定温度下,反应
H2(g)+
X2(g)?HX(g)的平衡常数为10.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、9.1% | B、10.0% |
| C、28.6% | D、71.5% |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:在一定温度下,反应
H2(g)+
X2(g)?HX(g)的平衡常数为10,则相同条件下HX分解的化学反应的平衡常数为
,然后设出HX分解的物质的量,利用化学平衡三段法来计算各物质平衡时的浓度,然后利用平衡常数为
来计算解答.
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 10 |
| 1 |
| 10 |
解答:
解:在一定温度下,反应
H2(g)+
X2(g)?HX(g)的平衡常数为10,则相同条件下HX分解的化学反应的平衡常数为
,设HX分解的物质的量为x,则
HX(g)?
H2(g)+
X2(g)(单位为mol)
开始1.0mol 0 0
转化 x
平衡1-x
故K=
=
所以x=0.17
故最大分解率为
×100%=17%,故最接近B,
故选B.
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 10 |
HX(g)?
| 1 |
| 2 |
| 1 |
| 2 |
开始1.0mol 0 0
转化 x
| x |
| 2 |
| x |
| 2 |
平衡1-x
| x |
| 2 |
| x |
| 2 |
故K=
(
| ||||||||
| 1-x |
| 1 |
| 10 |
所以x=0.17
故最大分解率为
| 0.17 |
| 1.0 |
故选B.
点评:本题考查学生利用平衡常数的计算,明确已知反应与HX分解反应的关键及化学平衡常数的关键是解答的关键,学生应熟悉化学平衡三段法计算的格式及步骤来解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
晨的树林,可以观测到一束束的阳光透过树叶,射入林间,这是种现象源自胶体的( )
| A、丁达尔效应 | B、聚沉 |
| C、电泳 | D、折射 |
下列离子方程式正确的是( )
| A、乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | ||
| B、醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O | ||
C、苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O
| ||
D、甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-
|
元素性质呈周期性变化的决定因素是( )
| A、元素原子半径大小呈周期性变化 |
| B、元素原子最外层电子排布呈周期性变化 |
| C、元素原子量依次递增 |
| D、元素的最高正化合价呈周期性变化 |
 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A、b点表示的溶液中c(CH3COO-)>c(Na+) | ||
| B、c点表示CH3COOH和NaOH恰好反应完全 | ||
| C、a、b点间一定存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | ||
D、b、d点表示的溶液中
|
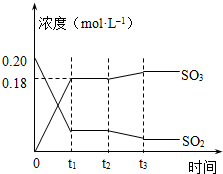 已知2SO2 (g)+O2(g)?2SO3(g)△H=-196kJ?mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡.如图所示:
已知2SO2 (g)+O2(g)?2SO3(g)△H=-196kJ?mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡.如图所示: