题目内容
8.镁铝合金因坚硬、轻巧、美观、易于加工等优点,主要用于制作窗框、防护栏等.下列物质性质与这些用途无关的是( )| A. | 密度小 | B. | 强度高 | C. | 不易生锈 | D. | 导电性好 |
分析 铝镁合金具有耐腐蚀性、密度小、机械强度高等方面的特点.
解答 解:铝镁合金用于制作门窗、防护栏等时主要是利用了铝镁合金具有耐腐蚀性、密度小、机械强度高等方面的特点,与导电性是否良好无关.
故选D.
点评 本题考查的是合金的性质及应用,性质决定用途,用途体现性质,根据镁铝合金的性质判断即可,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
| A. | X的能量一定高于M,Y的能量一定高于N | |
| B. | 因该反应为放热反应,故不必加热就可以发生 | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 破坏反应物中的化学键所吸收的能量大于形成生成物中的化学键所放出的能量 |
19.将12g由Mg、Zn、Fe组成的混合物与50mL稀硫酸恰好完全反应,产生的氢气在标准状况下为5.6L,则三种金属的物质量之和为( )
| A. | 0.5mol | B. | 0.25mol | C. | 0.1mol | D. | 0.125mol |
3.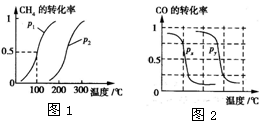 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为l00L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)
I.CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了如表的实验设计表中.如表中剩余的实验条件数据:
n=150,m=$\frac{1}{3}$.
b.根据反应Ⅱ的特点,如图2是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为l00L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)
I.CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了如表的实验设计表中.如表中剩余的实验条件数据:
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | n | $\frac{1}{3}$ | 5 |
| 3 | 350 | m | 5 |
b.根据反应Ⅱ的特点,如图2是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.
20.某溶液中只可能含有下列离子中的几种:K+、NO3-、SO42-、NH4+、CO32-(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
下列说法正确的是( )
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
下列说法正确的是( )
| A. | 该溶液中一定不含NO3- | |
| B. | 该溶液中一定含K+,且c(K+)≥0.1mol/L | |
| C. | 该溶液中可能含K+ | |
| D. | 该溶液中肯定含有NO3?、SO42-、NH4+、CO32- |
17.某有机物的结构简式为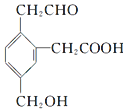 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )
①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦缩聚.
 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦缩聚.
| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤⑦ | D. | ②③④⑤⑥ |
18.无机化合物可根据其组成和性质进行分类,
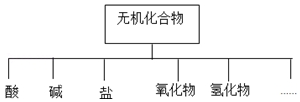
(1)如图所示的物质分类方法名称是树状分类法.
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在表中②、④、⑥、⑩后面.
(3)SO2和CO2都属于酸性氧化物,在化学性质上有很多相似的地方,请写出少量的⑦与③反应的化学反应方程式为:SO2+2NaOH=Na2SO3+H2O.
(4)磷的一种化合物叫亚磷酸(H3PO3),从交叉分类的角度看,它属于二元弱酸,则Na2HPO3属于正盐盐(填正盐、酸式盐或碱式盐).

(1)如图所示的物质分类方法名称是树状分类法.
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在表中②、④、⑥、⑩后面.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② | ③NaOH ④ | ⑤Na2SO4 ⑥ | ⑦SO2 ⑧ | ⑨NH3 ⑩ |
(4)磷的一种化合物叫亚磷酸(H3PO3),从交叉分类的角度看,它属于二元弱酸,则Na2HPO3属于正盐盐(填正盐、酸式盐或碱式盐).
 反应:aA(g)+bB(g)?cC(g)△H<0 在2L恒容容器中进行.改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
反应:aA(g)+bB(g)?cC(g)△H<0 在2L恒容容器中进行.改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示: