题目内容
19.将12g由Mg、Zn、Fe组成的混合物与50mL稀硫酸恰好完全反应,产生的氢气在标准状况下为5.6L,则三种金属的物质量之和为( )| A. | 0.5mol | B. | 0.25mol | C. | 0.1mol | D. | 0.125mol |
分析 标况下5.6L氢气的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,故12g金属提供的电子为0.25mol×2=0.5mol,金属Mg、Zn、Fe与硫酸反应都表现为+2价,利用电子转移守恒计算三种金属的物质量之和.
解答 解:标准状况下为5.6L气体的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,
金属Mg、Zn、Fe与硫酸反应都表现为+2价,利用电子转移守恒计算三种金属的物质量之和,
故有2n(Mg)+2n(Zn)+2n(Fe)=2n(H2),
即n(Mg)+n(Zn)+n(Fe)=n(H2)=0.25mol,
故选B.
点评 本题考查混合物的有关计算,难度中等,可以利用方程式判断金属与氢气的物质的量关系.

练习册系列答案
相关题目
9.青蒿酸是合成青蒿素的原料,其结构如图所示.下列有关青蒿酸的说法正确的是( )
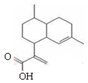

| A. | 青蒿素分子式为:C15H20O2 | |
| B. | 1 mol青蒿酸可与3 mol H2发生加成反应 | |
| C. | 在一定条件,可与乙醇发生酯化反应 | |
| D. | 能使溴水褪色,不能使酸性高锰酸钾溶液褪色 |
10.在常温下发生下列反应:
①16H++10Z-+2XO4-═2X2++5Z2+8H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
根据上述反应,判断下列结论中错误的是( )
①16H++10Z-+2XO4-═2X2++5Z2+8H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
根据上述反应,判断下列结论中错误的是( )
| A. | 溶液中可能发生反应Z2+2A2+=2A3++2Z- | |
| B. | Z2在①③反应中作还原剂 | |
| C. | 氧化性强弱顺序为XO4->Z2>B2>A3+ | |
| D. | X2+是XO4-的还原产物 |
7.下列变化属于化学变化的是( )
| A. | 碘的升华 | B. | 金属的焰色反应 | C. | 液溴的气化 | D. | 漂白粉久置失效 |
14.下列晶体性质的比较中正确的是( )
| A. | 沸点:NH3>H2O>HF | B. | 熔点:金刚石>碳化硅>晶体硅 | ||
| C. | 硬度:白磷>冰>二氧化硅 | D. | 熔点:SiI4<SiBr4<SiCl4 |
1.如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
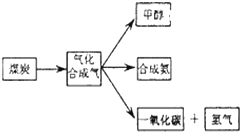
(1)已知该产业链中煤炭气化反应C(s)+H2O(g)═CO(g)+H2(g)的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$.
(2)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)此温度下,在恒容密闭容器中开始只加入CO、H2,反应l0min后达到平衡,测得各组分的浓度如下:
①该时间段内反应速率v(H2)=0.08mol/(L•min),
②反应达到平衡后,其它条件不变,能判断该反应达到化学平衡状态的标志是ac
a.体系压强不变
b.混合气体的密度不变
c.混合气体的平均摩尔质量不变
d.v正(H2)=v逆(CH3OH)
③已知在常温常压下:
a.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H 1
b.2CO (g)+O2(g)═2CO2(g)△H2
c.H2O(g)═H2O(l)△H3
则2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l)△H=△H1-△H2+4△H3(用含△H 1、△H2、△H3 的式子表示)
(3)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池.则充入 CH3OH的电极为负极,正极反应的电极反应式为O2+2H2O+4e-=4OH-.

(1)已知该产业链中煤炭气化反应C(s)+H2O(g)═CO(g)+H2(g)的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$.
(2)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)此温度下,在恒容密闭容器中开始只加入CO、H2,反应l0min后达到平衡,测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
②反应达到平衡后,其它条件不变,能判断该反应达到化学平衡状态的标志是ac
a.体系压强不变
b.混合气体的密度不变
c.混合气体的平均摩尔质量不变
d.v正(H2)=v逆(CH3OH)
③已知在常温常压下:
a.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H 1
b.2CO (g)+O2(g)═2CO2(g)△H2
c.H2O(g)═H2O(l)△H3
则2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l)△H=△H1-△H2+4△H3(用含△H 1、△H2、△H3 的式子表示)
(3)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池.则充入 CH3OH的电极为负极,正极反应的电极反应式为O2+2H2O+4e-=4OH-.
8.镁铝合金因坚硬、轻巧、美观、易于加工等优点,主要用于制作窗框、防护栏等.下列物质性质与这些用途无关的是( )
| A. | 密度小 | B. | 强度高 | C. | 不易生锈 | D. | 导电性好 |
6.下列说法中正确的是( )
| A. | Fe与S混合加热生成FeS2 | |
| B. | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
 某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.
某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.