题目内容
1.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )| A. | X的能量一定高于M,Y的能量一定高于N | |
| B. | 因该反应为放热反应,故不必加热就可以发生 | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 破坏反应物中的化学键所吸收的能量大于形成生成物中的化学键所放出的能量 |
分析 反应X+Y=M+N为放热反应,反应前后能量守恒,则反应物的总能量比生成物的总能量高,断裂化学键吸收能量,形成化学键放出能量,以此来解答.
解答 解:A.反应物的总能量大于生成物的总能量,X的能量与M的能量关系和Y的能量与N的能量关系都无法确定,故A错误;
B.反应的放热、吸热与反应条件(如加热)无关,某些放热反应也需要加热才能反应,如氢气和氧气的反应,故B错误;
C.反应物的总能量大于生成物的总能量,反应为放热反应,X和Y的总能量一定高于M和N的总能量,故C正确;
D.反应是放热反应,破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量,故D错误;
故选C.
点评 本题考查放热反应与反应物和生成物的总能量的关系,为高频考点,侧重于学生的分析能力的考查,注意信息中反应为放热反应来解答,难度不大.

练习册系列答案
相关题目
11.同温同压下,质量相等的O2和CO2 相比较,下列叙述正确的是( )
| A. | 体积之比11:8 | B. | 密度之比 11:8 | ||
| C. | 物质的量之比8:11 | D. | 原子数之比8:11 |
12.下列说法正确的是( )
| A. | 冰水混合物是纯净物 | B. | 金属氧化物均为碱性氧化物 | ||
| C. | Fe(OH)3胶体带正电 | D. | 同种元素组成的物质一定是纯净物 |
9.青蒿酸是合成青蒿素的原料,其结构如图所示.下列有关青蒿酸的说法正确的是( )
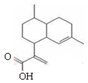

| A. | 青蒿素分子式为:C15H20O2 | |
| B. | 1 mol青蒿酸可与3 mol H2发生加成反应 | |
| C. | 在一定条件,可与乙醇发生酯化反应 | |
| D. | 能使溴水褪色,不能使酸性高锰酸钾溶液褪色 |
13.下列反应的离子方程式书写正确的是( )
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 硝酸银与盐酸反应:AgNO3+Cl-═NO3-+AgCl↓ |
10.在常温下发生下列反应:
①16H++10Z-+2XO4-═2X2++5Z2+8H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
根据上述反应,判断下列结论中错误的是( )
①16H++10Z-+2XO4-═2X2++5Z2+8H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
根据上述反应,判断下列结论中错误的是( )
| A. | 溶液中可能发生反应Z2+2A2+=2A3++2Z- | |
| B. | Z2在①③反应中作还原剂 | |
| C. | 氧化性强弱顺序为XO4->Z2>B2>A3+ | |
| D. | X2+是XO4-的还原产物 |
8.镁铝合金因坚硬、轻巧、美观、易于加工等优点,主要用于制作窗框、防护栏等.下列物质性质与这些用途无关的是( )
| A. | 密度小 | B. | 强度高 | C. | 不易生锈 | D. | 导电性好 |