题目内容
13. 反应:aA(g)+bB(g)?cC(g)△H<0 在2L恒容容器中进行.改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
反应:aA(g)+bB(g)?cC(g)△H<0 在2L恒容容器中进行.改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:回答问题:
(1)反应的化学方程式中,a:b:c═1:3:2.
(2)由第一次平衡到第二次平衡,平衡移动的方向是平衡正向移动,采取的措施是从反应体系中移出产物C,
(3)比较第二阶段反应温度(T2)和第三阶段反应温度(T3)的高低:T2>T3(填“>”“<”或“=”),判断的理由是此反应为放热反应,降低温度,平衡向正反应方向移动.
(4)第三阶段平衡常数K3 的计算式$\frac{(0.5mol/L)^{2}}{0.25mol/L×(0.75mol/L)^{3}}$.
分析 (1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,根据浓度变化量之比等于化学计量数之比计算;
(2)第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动;
(3)第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低;
(4)第三阶段平衡时,A的平衡物质的量为0.50mol/L,B的平衡物质的量为1.50mol,C的物质的量为1.00mol/L,根据平衡常数的计算公式建立平衡常数计算式;
解答 解:Ⅰ.(1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,浓度变化量之比等于化学计量数之比,故a:b:c=1mol/L:3mol/L:2mol/L=1:3:2,
故答案为:1:3:2;
(2)第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动,
故答案为:平衡正向移动;从反应体系中移出产物C;
(3)第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低,
故答案为:>;此反应为放热反应,降低温度,平衡向正反应方向移动;
(4)可逆反应A+3B?2C第三阶段达到平衡时A的平衡浓度为0.25mol/L,B的平衡浓度为0.75mol/L,C的平衡浓度为0.50mol/L,此时K=$\frac{(0.5mol/L)^{2}}{0.25mol/L×(0.75mol/L)^{3}}$,故答案为:$\frac{(0.5mol/L)^{2}}{0.25mol/L×(0.75mol/L)^{3}}$;
点评 本题考查化学反应速率与化学平衡图象、化学平衡有关计算、化学反应速率、化学平衡影响因素及化学反应与能量变化等,注意合理分析题中信息数据,题目难度中等.

| A. | 碘的升华 | B. | 金属的焰色反应 | C. | 液溴的气化 | D. | 漂白粉久置失效 |
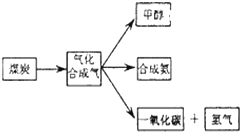
(1)已知该产业链中煤炭气化反应C(s)+H2O(g)═CO(g)+H2(g)的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$.
(2)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)此温度下,在恒容密闭容器中开始只加入CO、H2,反应l0min后达到平衡,测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
②反应达到平衡后,其它条件不变,能判断该反应达到化学平衡状态的标志是ac
a.体系压强不变
b.混合气体的密度不变
c.混合气体的平均摩尔质量不变
d.v正(H2)=v逆(CH3OH)
③已知在常温常压下:
a.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H 1
b.2CO (g)+O2(g)═2CO2(g)△H2
c.H2O(g)═H2O(l)△H3
则2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l)△H=△H1-△H2+4△H3(用含△H 1、△H2、△H3 的式子表示)
(3)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池.则充入 CH3OH的电极为负极,正极反应的电极反应式为O2+2H2O+4e-=4OH-.
| A. | 密度小 | B. | 强度高 | C. | 不易生锈 | D. | 导电性好 |
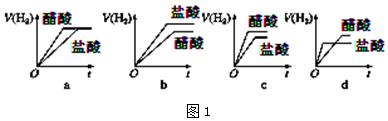
(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加水稀释10倍后,醋酸溶液中的c(H+)>盐酸溶液中的c(H+)(填“>”、“=”或“<”).
②加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积:醋酸>盐酸(填“>”、“=”或“<”).
③使温度都升高20℃,溶液中c(H+):醋酸>盐酸(填“>”、“=”或“<”).
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图(图1)正确的是
c(填字母).
(2)图2是不的电解质溶液中加入新物质时溶液的导电性能发生变化性情况(电流强度(I)随新物质加入量(m)的变化曲线),将对应的图象字母填写在下列横线上.
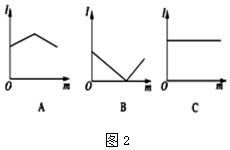
①氢氧化钡溶液中滴入硫酸溶液至过量B.
②醋酸溶液中滴入氨水至过量A.
③澄清石灰水中通入CO2至过量B.
(3)已知表中的电离平衡常数,回答问题
| K1 | K2 | |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
②H2SO3溶液与NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
 某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.
某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.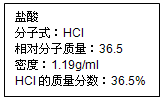 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: