题目内容
3. 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为l00L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)
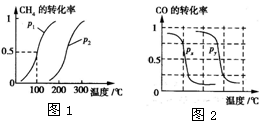
I.CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了如表的实验设计表中.如表中剩余的实验条件数据:
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | n | $\frac{1}{3}$ | 5 |
| 3 | 350 | m | 5 |
b.根据反应Ⅱ的特点,如图2是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.
分析 (1)①根据图知道平衡时甲烷的转化率,求出△c(CH4),根据v=$\frac{△c}{△t}$计算v(CH4),利用速率之比等于化学计量数之比计算v(H2).
②根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;
平衡常数k=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$,计算出平衡时,各组分的浓度,代入平衡常数计算.
③由图可知,温度越高甲烷的转化率越大,即升高温度平衡向正反应方向移.
(2)①容器容积不变,增加甲醇产率,平衡向正反应移动,根据外界条件对平衡的影响分析.
②a.采取控制变量法,探究合成甲醇的温度和压强的适宜条件,据此判断a、b的值.
b.根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时CO的转化率,由此判断.
解答 解:(1)①由图知道平衡时甲烷的转化率为0.5,所以△c(CH4)=$\frac{1.0mol×0.5}{100L}$=0.005mol/L,
所以v(CH4)=$\frac{0.005mol/L}{5min}$=0.001mol/(L•min),速率之比等于化学计量数之比,所以v(H2)=3v(CH4)=3×0.001mol/(L•min)=0.003mol/(L•min).
故答案为:0.003mol/(L•min);
②温度相同时,作垂直x轴的辅助线,发现压强为P1的CH4的转化率高,反应为前后体积增大的反应,压强增大平衡向体积减小的方向移动,即向逆反应移动,CH4的转化率降低,所以P1<P2.
CH4(g)+H2O(g)?CO(g)+3H2(g),
开始(mol):1.0 2.0 0 0
变化(mol):1.0×0.5 0.5 0.5 1.5
平衡(mol):0.5 1.5 0.5 1.5
所以平衡常数k=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$=$\frac{\frac{0.5mol}{100L}×(\frac{1.5mol}{100L})^{3}}{\frac{0.5mol}{100L}×\frac{1.5mol}{100L}}$=2.25×10-4,
故答案为:<;2.25×10-4;
③由图可知,温度越高甲烷的转化率越大,即升高温度平衡向正反应方向移,温度升高平衡向吸热方向移动,所以正反应为吸热反应,即△H>0,
故答案为:>;
(2)①A、该反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应方向移动,甲醇的产率降低,故A错误;
B、将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,甲醇的产率增加,故B错误;
C、充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D、再充入1mol CO和3mol H2,可等效为压强增大,平衡向体积减小的方向移动,即向正反应方向移动,甲醇的产率增加,故D正确.
故选:BD,
故答案为:BD;
②a、采取控制变量法,探究合成甲醇的温度和压强的适宜条件,所以温度、压强是变化的,$\frac{n(CO)}{n({H}_{2})}$应保持不变,所以m=$\frac{1}{3}$;比较使用1、2,压强不同,所以温度应相同,故n=150.
故答案为:150;$\frac{1}{3}$;
b、温度相同时,作垂直x轴的辅助线,发现压强为Py的CO的转化率高,反应为前后体积减小的反应,压强增大平衡向体积减小的方向移动,即向正反应移动,所以Px<Py,所以压强Px=0.1MPa.
故答案为:0.1.
点评 本题考查化学反应速率、平衡常数、化学平衡计算、化学平衡的影响因素及读图能力等,综合性较大,难度中等,知识面广,应加强平时知识的积累.注意控制变量法与定一议二原则应用.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 150mL1mol/L NaCl溶液 | B. | 75mL2mol/L NH4Cl溶液 | ||
| C. | 150mL3mol/L KCl溶液 | D. | 75mL1mol/L CuCl2溶液 |
| A. | 沸点:NH3>H2O>HF | B. | 熔点:金刚石>碳化硅>晶体硅 | ||
| C. | 硬度:白磷>冰>二氧化硅 | D. | 熔点:SiI4<SiBr4<SiCl4 |
| A. | 用加入适量铁粉的方法除去Cu(NO3)2溶液中混有的AgNO3杂质 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体的混合物 | |
| D. | 先后添加石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
| A. | 密度小 | B. | 强度高 | C. | 不易生锈 | D. | 导电性好 |
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(2)实验①、③可探究浓度对反应速率的影响,因此V4、V5分别是10.0、6.0.
| 序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉,并过滤 |
| ③ | H2 | CO2 | 通过盛NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| ④ | NaNO3固体 | CaCO3 | 溶解、过滤、蒸发 |
| A. | ①②③④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |