题目内容
1.硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]是分析化学中重要的试剂,学习小组探究其分解产物.(1)甲组按照图1所示的装置进行实验,关闭止水夹并加热A中的硫酸亚铁铵固体至分解完全,检验其分解产物.

①装置B仪器名称是干燥管,所放试剂是碱石灰.
②装置C中可观察到的现象是溶液由无色变红色,由此可知硫酸亚铁铵的分解产物中有NH3.(写化学式)
(2)乙组选用甲组实验中的装置A和图2所示的装置进行实验验证硫酸亚铁铵分解的产物中还有SO2和SO3.
①乙组同学的实验装置中,依次连接的合理顺序(用装置的字母表示)为A、DHEGF;取适量硫酸亚铁铵固体于A中,通入一段时间N2后,关闭止水夹再点燃酒精灯,通入N2的目的是排尽装置中的空气(或O2),防止对SO2的验证产生干扰.
②装置H中有白色沉淀,则证明分解产物中有SO3;G中发生反应的离子方程式为SO2+2H2O2+Ba2+=BaSO4↓+H2O+2H+.
(3)丙组将一定量的硫酸亚铁铵在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明:此固体产物不含二价铁:取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色.
分析 (1)①装置B的形状和作用可知为干燥管,盛放固体干燥剂,检验氨气利用装置C中的酚酞溶液,装置B是除去生成的硫的氧化物;
②装置C中可观察到的现象是变红色,证明分解产物中生成了氨气;
(2)①乙组选用甲组实验中的装置A和图2所示的装置进行实验验证硫酸亚铁铵分解的产物中还有SO2和SO3,分解产物通过装置D防止倒吸,通过装置H中的足量元素和氯化钡溶液检验是否生成气体中含三氧化硫,通过装置E检验三氧化硫是否除净,通过装置G过氧化氢氧化二氧化硫为硫酸,结合钡离子生成白色沉淀,最后剩余二氧化硫气体需要尾气吸收,通入一段时间N2后,关闭止水夹再点燃酒精灯,目的是干净装置中的氧气避免对二氧化硫检验的干扰;
②装置H中有白色沉淀,说明生成了不溶于水、不溶于酸的沉淀为硫酸钡沉淀,G中过氧化氢氧化二氧化硫为了谁,和氯化钡反应生成硫酸钡不是沉淀;
(3)利用二价铁离子具有还原性设计实验检验.
解答 解:(1)①装置B的形状和作用可知为干燥管,盛放固体干燥剂,硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]分解可能的产物为氨气、硫的氧化物和水,检验氨气利用装置C中的酚酞溶液,所以装置B是除去生成的硫的氧化物为碱石灰,
故答案为:干燥管;碱石灰;
②装置C中可观察到的现象是变红色,氨气溶于水生成一水合氨是弱碱,溶液中电离显碱性,遇到酚酞变红色,证明分解产物中生成了氨气,
故答案为:溶液由无色变红色;NH3;
(2)①乙组选用甲组实验中的装置A和图2所示的装置进行实验验证硫酸亚铁铵分解的产物中还有SO2和SO3,分解产物通过装置D防止倒吸,通过装置H中的足量元素和氯化钡溶液检验是否生成气体中含三氧化硫,通过装置E检验三氧化硫是否除净,通过装置G过氧化氢氧化二氧化硫为硫酸,结合钡离子生成白色沉淀,最后剩余二氧化硫气体需要尾气吸收,据上述分析可知装置连接顺序为ADHEGF,取适量硫酸亚铁铵固体于A中,通入一段时间N2后,关闭止水夹再点燃酒精灯,目的是干净装置中的氧气避免对二氧化硫检验的干扰,
故答案为:DHEGF;排尽装置中的空气(或O2),防止对SO2的验证产生干扰;
②装置H中有白色沉淀,说明生成了不溶于水、不溶于酸的沉淀为硫酸钡沉淀,原气体中生成了SO3,G中过氧化氢氧化二氧化硫生成硫酸,硫酸和氯化钡反应生成硫酸钡白色沉淀,反应的离子方程式为:SO2+2H2O2+Ba2+=BaSO4↓+H2O+2H+,
故答案为:SO3 ;SO2+2H2O2+Ba2+=BaSO4↓+H2O+2H+;
(3)利用二价铁离子具有还原性设计实验检验,实验设计为:取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色,故答案为:取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色.
点评 本题考查了物质性质、物质分解产物的实验验证,注意检验实验设计应避免干扰验,试剂选择和反应现象的理解应用是解题关键,题目难度中等.

 特高级教师点拨系列答案
特高级教师点拨系列答案①金属晶体中存在离子,但却不存在离子键
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体硬度一般比分子晶体大,分子晶体熔点不一定比金属晶体低
④固态能导电的一定是金属晶体
⑤NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能小
⑥原子晶体一定由原子构成,由原子构成的晶体不一定是原子晶体
⑦共价化合物中可能含有离子键
⑧金属晶体中简单立方堆积的配位数是8,空间利用率最低.
| A. | 只有②③④ | B. | 只有②③⑦ | C. | 只有①③⑥ | D. | 只有⑤⑥⑧ |
| A. | 硝酸型酸雨的形成:3NO2+H2O═2HNO3+NO | |
| B. | 用Fe2(SO4)3做净水剂:Fe3++3H2O?Fe(OH)3+3H+ | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:Ca2++CO32-═CaCO3↓ | |
| D. | 向5 mL 0.1mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
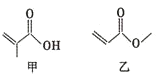
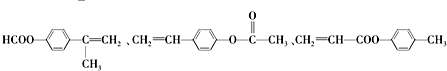
| A. | 甲、乙互为同分异构体 | |
| B. | 一定条件下,甲、乙均能发生取代反应 | |
| C. | 甲、乙都能与金属钠反应生成氢气 | |
| D. | 甲、乙都能使酸性KMnO4溶液褪色 |
| A. | NA个Fe(OH)3胶体粒子的质量为107g | |
| B. | 标准状况下,1L液态水中含有的H+数目为10-7NA | |
| C. | 14g分子式为CnH2n的链烃中含有的碳碳双键的数目为NA/n | |
| D. | 1 mol冰醋酸和l mo1乙醇经酯化反应可生成H2O分子数为NA |
 .
.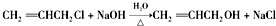 .
. .
. .
.