题目内容
9.下列解释事实的方程式不正确的是( )| A. | 硝酸型酸雨的形成:3NO2+H2O═2HNO3+NO | |
| B. | 用Fe2(SO4)3做净水剂:Fe3++3H2O?Fe(OH)3+3H+ | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:Ca2++CO32-═CaCO3↓ | |
| D. | 向5 mL 0.1mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
分析 A.二氧化氮与水反应生成硝酸和一氧化氮气体;
B.硫酸铁电离出的铁离子发生水解生成氢氧化铁胶体,氢氧化铁胶体能够净水;
C.水垢中的硫酸钙在离子方程式中不能拆开;
D.滴入浓硫酸后,溶液中氢离子浓度增大,抑制了重铬酸根离子的水解.
解答 解:A.二氧化氮与水反应生成硝酸是硝酸型酸雨的形成的原因,反应的化学方程式为:3NO2+H2O═2HNO3+NO,故A正确;
B.用Fe2(SO4)3做净水剂,利用的是铁离子的水解,反应的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,故B正确;
C.水垢中的CaSO4用Na2CO3溶液处理,硫酸钙不能拆开,正确的离子方程式为:CaSO4+CO32-═CaCO3+SO42-,故C错误;
D.向5 mL 0.1mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,Cr2O72-的水解程度减小,溶液橙色变深,反应的离子方程式为:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,故D正确;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
19.下列系统命名法正确的是( )
| A. | 4-乙基-2-戊烯 | B. | 3-甲基-3-戊醇 | ||
| C. | 2-甲基-1-戊炔 | D. | 2-甲基-3-乙基-2-丁醇 |
20.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 1 mol甲苯含有6NA个C-H键 | |
| B. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓硫酸中生成NA个SO2分子 |
17.下列关于物质性质的比较,不正确的是( )
| A. | 酸性强弱:HIO4<HBrO4<HClO4 | B. | 原子半径大小:Na>O>S | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
4.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 5.6g铁与足量稀硝酸反应,转移电子的数目为0.2NA | |
| B. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| C. | 8.8g乙酸乙酯中含共用电子对数为1.4NA | |
| D. | 1L 0.1mol•L-1氯化铜溶液中铜离子数为0.1NA |
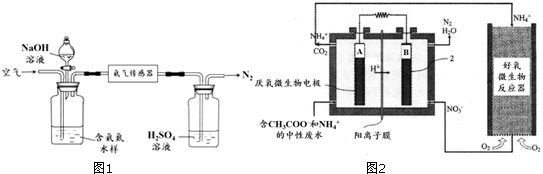
18. (一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(1)编号③的实验目的是探究pH对降解速率的影响.
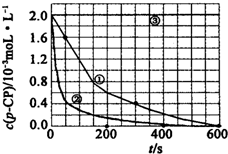
(2)实验测得不同实验编号中p-CP的浓度随时间变化的关系如图所示.请根据实验①曲线,计算降解反应在50-300s内的平均反应速率v(p-CP)=4.8×10-6mol•L-1•s-1.
(3)实验①②表明,温度与该降解反应速率的关系是温度越高,降解反应速率越快.
(二)已知Fe3+和I-在水溶液中的反应为2I-+2Fe3+=2Fe2++I2.正向反应速率和I-、Fe3+的浓度关系为v=kcm(I-)cn(Fe3+)(k为常数)
(4)请分析下表提供的数据回答以下问题:
①在v=kcm(I-)cn(Fe3+)中,m、n的值为C.(选填A、B、C、D)
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
②I-浓度对反应速率的影响>Fe3+浓度对反应速率的影响(填“<”、“>”或“=”).
(三)一定温度下,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的化学平衡常数为3.0,该温度下将2mol FeO、4mol CO、5mol Fe、6mol CO2加入容积为2L的密闭容器中反应.请通过计算回答:
(5)v(正)>v(逆)(填“>”、“<”或“=”);若将5mol FeO、4mol CO加入同样的容器中,在相同温度下达到平衡,则CO的平衡转化率为75%.
 (一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):| 实验序号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照物 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)实验测得不同实验编号中p-CP的浓度随时间变化的关系如图所示.请根据实验①曲线,计算降解反应在50-300s内的平均反应速率v(p-CP)=4.8×10-6mol•L-1•s-1.
(3)实验①②表明,温度与该降解反应速率的关系是温度越高,降解反应速率越快.
(二)已知Fe3+和I-在水溶液中的反应为2I-+2Fe3+=2Fe2++I2.正向反应速率和I-、Fe3+的浓度关系为v=kcm(I-)cn(Fe3+)(k为常数)
(4)请分析下表提供的数据回答以下问题:
| c(I-)/(mol•L-1) | c(Fe3+)/(mol•L-1) | v/(mol•L-1•s-1) | |
| (1) | 0.20 | 0.80 | 0.032k |
| (2) | 0.60 | 0.40 | 0.144k |
| (3) | 0.80 | 0.20 | 0.128k |
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
②I-浓度对反应速率的影响>Fe3+浓度对反应速率的影响(填“<”、“>”或“=”).
(三)一定温度下,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的化学平衡常数为3.0,该温度下将2mol FeO、4mol CO、5mol Fe、6mol CO2加入容积为2L的密闭容器中反应.请通过计算回答:
(5)v(正)>v(逆)(填“>”、“<”或“=”);若将5mol FeO、4mol CO加入同样的容器中,在相同温度下达到平衡,则CO的平衡转化率为75%.
19.下列指定反应的离子方程式正确的是( )
| A. | 碳酸的电离子方程式:H2CO3═2H++CO32- | |
| B. | 过量铁粉与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 次氯酸钠溶液中滴入浓盐酸产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Fe(OH)2↓+H2O |