题目内容
11.你认为下列对化学知识概括合理的组合是( )①金属晶体中存在离子,但却不存在离子键
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体硬度一般比分子晶体大,分子晶体熔点不一定比金属晶体低
④固态能导电的一定是金属晶体
⑤NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能小
⑥原子晶体一定由原子构成,由原子构成的晶体不一定是原子晶体
⑦共价化合物中可能含有离子键
⑧金属晶体中简单立方堆积的配位数是8,空间利用率最低.
| A. | 只有②③④ | B. | 只有②③⑦ | C. | 只有①③⑥ | D. | 只有⑤⑥⑧ |
分析 ①金属晶体是由金属阳离子和自由电子构成的;
②稀有气体分子中无化学键;
③根据分子晶体碘和金属晶体汞的熔点判断;
④固态导电的不一定是金属单质,石墨是非金属单质;
⑤氢化物沸点高低是和分子间作用力有关,与化学键无关;
⑥原子晶体一定由原子构成,由原子构成的晶体不一定是原子晶体;
⑦共价化合物只含有共价键;
⑧金属晶体的堆积方式中空间利用率分别是:简单立方52%,体心立方68%,面心立方为74%.
解答 解:①金属晶体是由金属阳离子和自由电子构成的,含有金属键不含离子键,故①正确;
②稀有气体分子形成分子晶体,晶体中无化学键,故②错误;
③原子晶体硬度一般比分子晶体大,分子晶体熔点不一定比金属晶体低,如熔点I2>Hg,故③正确;
④固态导电的物质不一定是金属单质,石墨是非金属单质,但石墨能导电,故④错误;
⑤氢化物沸点高低是和分子间作用力有关,与化学键无关,故⑤错误;
⑥原子晶体一定由原子通过共价键构成,由原子构成的晶体不一定是原子晶体,如稀有气体构成的分子晶体,故⑥正确;
⑦共价化合物只含有共价键,不含有离子键,故⑦错误;
⑧金属晶体的堆积方式中空间利用率分别是:简单立方52%,体心立方68%,面心立方为74%.因此简单立方的空间利用率最低,面心立方空间利用率最高,但是配位数是6,故⑧错误,
故选C.
点评 本题主要考查了金属晶体、晶体的堆积方式与原因以及晶体熔点的判断等,难度不大,注意对应知识的掌握.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
1.(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
其他条件不变时:探究温度对化学反应速率的影响,应选择①④(填实验编号);
探究浓度对化学反应速率的影响,应选择①②或③④(填实验编号);
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是5H2O+S2O32-+4Cl2=2SO42-+8Cl-+10H+.
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
探究浓度对化学反应速率的影响,应选择①②或③④(填实验编号);
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是5H2O+S2O32-+4Cl2=2SO42-+8Cl-+10H+.
2.下列有关说法不正确的是( )
| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜离子 | |
| C. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 | |
| D. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 |
19.下列系统命名法正确的是( )
| A. | 4-乙基-2-戊烯 | B. | 3-甲基-3-戊醇 | ||
| C. | 2-甲基-1-戊炔 | D. | 2-甲基-3-乙基-2-丁醇 |
16.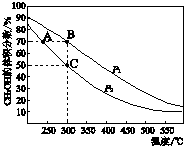 CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )
CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )
 CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )
CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )| A. | P1<P2 | B. | 该反应的△H>0 | ||
| C. | 平衡常数:K(A)=K(B) | D. | 在C点时,CO转化率为75% |
3.下列说法正确的是( )
| A. | 化学反应除了生成新的物质外,只伴随着热量的变化 | |
| B. | 物质燃烧不一定是放热反应,放热的化学反应不需要加热就能发生 | |
| C. | 太阳能、氢能、生物质能属于新能源 | |
| D. | 化石燃料是一次能源,乙醇是不可再生能源 |
20.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 1 mol甲苯含有6NA个C-H键 | |
| B. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O的反应中,生成28 g N2,转移的电子数目为3.75NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓硫酸中生成NA个SO2分子 |
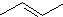 某有机物X的键线式为
某有机物X的键线式为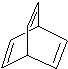 .
. ,
, .
.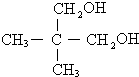 .
.