题目内容
18.1L cmol•L-1 NaOH溶液的密度是ρg•cm-3,计算NaOH溶液的质量分数?分析 依据C=$\frac{1000ρω}{M}$计算解答.
解答 解:cmol•L-1 NaOH溶液的密度是ρg•cm-3,其物质的量浓度为C=$\frac{1000ρω}{40}$,则ω=$\frac{C40}{1000ρ}$×100%=$\frac{C}{25ρ}$×100%;
答:1L cmol•L-1 NaOH溶液的密度是ρg•cm-3,其质量分数浓度为$\frac{C}{25ρ}$×100%.
点评 本题考查了有关物质的量浓度计算,熟悉物质的量浓度、质量百分数浓度之间的换算公式是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.某实验室用下列溶质配制一种混合溶液,已知溶液中:c(K+)=c(Cl-)=$\frac{1}{3}$ c(Na+)=$\frac{2}{3}$c(SO42-),则其溶质可能是( )
| A. | MgCl2、Na2SO4、K2SO4 | B. | KCl、Na2SO4、NaCl | ||
| C. | NaCl、Na2SO4、K2SO4 | D. | KCl、Na2SO4、K2SO4 |
9.下列元素中,一定属于主族元素的是( )
| A. | 元素的最高正化合价为+6 | |
| B. | 元素原子的最外层只有一个电子 | |
| C. | 原子核外各电子层的电子数均达到饱和 | |
| D. | 其最高价氧化物溶于水是强酸,且有气态氢化物 |
1.工业上用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的Mn02和Zn的工艺流程如下:
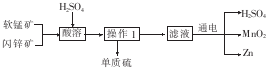
下列说法正确的是( )

下列说法正确的是( )
| A. | 酸溶时,ZnS作氧化剂 | B. | 硫酸可以循环使用 | ||
| C. | 可用盐酸代替硫酸进行酸溶 | D. | MnO2和ZnS均属于盐 |
8.下表列出了A-R9种元素在周期表中的位置
(1)这9种元素分别为H,Na,Mg,Al,C,O,F,Cl,Ne其中化学性质最不活泼的是Ne(以上均填元素符号)
(2)B、C、D三种元素按原子半径由大到小的顺序排列为Na>Mg>Al(用元素符号表示)
(3)F元素简单氢化物的化学式是H2O,H元素跟B元素形成化合物的化学式是NaCl,高温灼烧该化合物时,火焰呈黄色.
(4)G元素和H元素两者核电荷数之差是8.
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | E | F | G | R | ||||
| 3 | B | C | D | H |
(2)B、C、D三种元素按原子半径由大到小的顺序排列为Na>Mg>Al(用元素符号表示)
(3)F元素简单氢化物的化学式是H2O,H元素跟B元素形成化合物的化学式是NaCl,高温灼烧该化合物时,火焰呈黄色.
(4)G元素和H元素两者核电荷数之差是8.
6.用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH保持不变的是( )
| A. | KCl | B. | NaOH | C. | CuSO4 | D. | Na2SO4 |