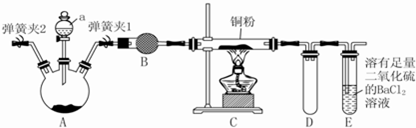
题目内容
8.某实验室用下列溶质配制一种混合溶液,已知溶液中:c(K+)=c(Cl-)=$\frac{1}{3}$ c(Na+)=$\frac{2}{3}$c(SO42-),则其溶质可能是( )| A. | MgCl2、Na2SO4、K2SO4 | B. | KCl、Na2SO4、NaCl | ||
| C. | NaCl、Na2SO4、K2SO4 | D. | KCl、Na2SO4、K2SO4 |
分析 根据c(K+)=c(Cl-)=$\frac{1}{3}$ c(Na+)=$\frac{2}{3}$c(SO42-),结合各选项中溶质的组成进行判断是否满足各离子浓度关系即可.
解答 解:A.若溶质为MgCl2、Na2SO4、K2SO4,根据物料守恒知,c(Na+)<2c(SO42-),与$\frac{1}{3}$c(Na+)=$\frac{2}{3}$c(SO42-)不符,故A错误;
B.若溶质为KCl、Na2SO4、NaCl,则c(Na+)>2c(SO42-),与$\frac{1}{3}$c(Na+)=$\frac{2}{3}$c(SO42-)不符,故B错误;
C.若溶质为NaCl、Na2SO4、K2SO4,溶液中的离子可能存在c(K+)=c(Cl-)=0.5c(Na+)=c(SO42-),故C正确;
D.若溶质为KCl、Na2SO4、K2SO4,则c(K+)>c(Cl-),与c(K+)=c(Cl-)不符,故D错误;
故选C.
点评 本题考查电解质在水中的电离及离子浓度的关系,明确电解质在水中电离产生的离子及离子的物质的量的关系即可解答,难度不大.

练习册系列答案
相关题目
18.下列化学反应的离子方程式正确的是( )
| A. | 硫酸工业尾气中的SO2用过量的氨水吸收:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | FeO和稀HNO3的反应:FeO+2H+═Fe2++H2O | |
| C. | 向NH4Cl溶液中滴入烧碱溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3•H2O | |
| D. | 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- |
16.银锌碱性电池的电解质溶液为KOH溶液,电池放电时发生的总反应为Ag2O2+2Zn+4KOH+2H2O═2K2Zn(OH)4+2Ag,下列说法不正确的是( )
| A. | 放电时OH-向负极移动 | |
| B. | Ag2O2在反应中既是氧化剂又是还原剂 | |
| C. | 每生成1mol Ag外电路转移2 mol电子 | |
| D. | 负极反应为:Zn+4OH--2e-═Zn(OH)42- |
13.如果a g某气体中含有的分子数为b个,则c g该气体在标准状况下的体积(单位:升)是(NA表示阿伏加德罗常数)( )
| A. | 22.4ac/bNA | B. | 22.4ab/cNA | C. | 22.4bc/aNA | D. | 22.4b/acNA |