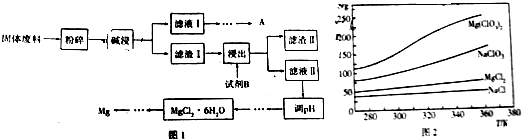
题目内容
13.某物质中含有6.02×1022个Na+,则Na+物质的量为多少?分析 根据n=$\frac{N}{{N}_{A}}$计算出6.02×1022个Na+物质的量.
解答 解:某物质中含有6.02×1022个Na+,则Na+物质的量为:n(Na+)=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$mol=0.1mol,
答:钠离子的物质的量为0.1mol.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数的关系为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
4.根据元素周期律及物质结构的有关知识,以下有关排序正确的是( )
| A. | 稳定性:HCl>H2S>H2O | B. | 酸性:HClO4>HNO3>H3PO4 | ||
| C. | 还原性:HCl>HBr>HI | D. | 碱性:NaOH>Mg(OH)2>Ba(OH)2 |
1.下列叙述正确的是( )
| A. | 碱性氧化物一定是金属氧化物 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 酸分子中有几个H原子即为几元酸 | |
| D. | 盐电离时,只生成一种阳离子,一种阴离子 |
3.已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量下列叙述正确的是( )
| A. | 氢气和氯气反应生成氯化氢气的热化学方程式是H2(g)+Cl2(g)=2HCl(g) | |
| B. | 氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183 kJ•mol-1 | |
| C. | 氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183 kJ•mol-1 | |
| D. | 氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183 kJ•mol-1 |
1.在空气中铝制品比铁制品耐腐蚀的原因是( )
| A. | 铝的活泼性不如铁 | |
| B. | 铝与空气中的氧气不易发生化学反应 | |
| C. | 铝易在空气中形成致密的氧化膜 | |
| D. | 铝的密度比铁的密度小 |
 .
.