题目内容
15.已知常温下,溶液中能发生如下反应:①2R-+Z2=R2+2Z-②16H++10Z-+2XO4-=2X2++5Z2+8H2O③2M2++2R2=2M3++2R-由此判断,下列说法中正确的是( )| A. | Z2+2M2+=2 M3++2Z-不可以进行 | |
| B. | Z元素在①②反应中发生还原反应 | |
| C. | 各粒子还原性由强到弱的顺序是X2+>Z->R->M2+ | |
| D. | 各粒子氧化性由强到弱的顺序是XO4->Z2>R2>M3+ |
分析 反应②16H++10Z-+2XO4-=2X2++5Z2+8H2O中,Z元素的化合价升高,X元素的化合价降低;③2M2++2R2=2M3++2R-中,M元素的化合价升高,R元素的化合价降低;①2R-+Z2=R2+2Z-中,Z元素的化合价降低,R元素的化合价升高,结合氧化还原反应基本概念及氧化剂的氧化性大于氧化产物的氧化性、还原剂的还原性大于还原产物的还原性来解答.
解答 解:A.根据还原性顺序:Z-<M2+,常温下可发生反应2M2++Z2═2M3++2Z-,故A错误;
B.②中Z元素化合价升高,被氧化,发生氧化反应,故B错误;
C.根据反应2M2++R2═2M3++2R-,可得还原性顺序是:R-<M2+,根据反应2R-+Z2═R2+2Z-,可得还原性顺序是Z-<R-,根据反应:16H++10Z-+2XO4-=2X2++5Z2+8H2O,可得还原性顺序是:X2+<Z-,即还原性强弱顺序为:X2+<Z-<R-<M2+,故C错误;
D.氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,反应16H++10Z-+2XO4-=2X2++5Z2+8H2O中,氧化性XO4->Z2;反应2M2++R2═2M3++2R-中,氧化性R2>M3+;反应2R-+Z2═R2+2Z-中,氧化性:Z2>R2,即氧化性顺序是XO4->Z2>R2>M3+,故D正确.
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及氧化性、还原性比较的考查,题目难度不大.

练习册系列答案
相关题目
3.10月11日早上7点30分,万众瞩目的神舟十一号飞船发射成功.其运载火箭点火后,偏二甲肼与四氧化二氮发生剧烈的氧化还原反应:(CH3)2NNH2+2N2O4═2CO2+4H2O+3N2,该反应中四氧化二氮属于( )
| A. | 还原剂 | B. | 氧化剂 | C. | 还原产物 | D. | 氧化产物 |
10.常温时,pH=14和pH=10的两种NaOH溶液等体积混合,所得溶液中c(H+)是( )
| A. | pH>7 | B. | pH=7 | C. | pH<7 | D. | 无法确定 |
20.下列实验操作中所用仪器合理的是( )
| A. | 用100mL容量瓶配制70mL0.1mol/L盐酸 | |
| B. | 用托盘天平称取25.20g氯化钠 | |
| C. | 用20mL的量筒量取13.86mL NaOH溶液 | |
| D. | 用蒸发皿加热胆矾晶体 |
7.下列叙述正确的是( )
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | |
| B. | pH=2的酸溶液1mL,加水稀释至100mL后,溶液pH=4 | |
| C. | 过量SO2通入Ba(NO3)2溶液中,正确的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+ | |
| D. | 用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液,所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb |
4.下列离子方程式书写正确的是( )
| A. | Na投入到水中:Na+H2O═Na++OH-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 三氯化铁溶液中加入铜粉:Fe3++Cu═Fe2++Cu2+ | |
| D. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
5.在无色、碱性溶液中能大量共存的一组离子是( )
| A. | Ca2+、Na+、SO42-、CO32- | B. | K+、Fe2+、SO42-、MnO4- | ||
| C. | Ba2+、K+、Al3+、Cl- | D. | Na+、Ba2+、Cl-、NO3- |
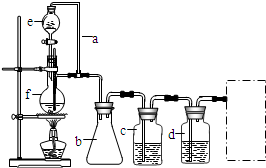 某学习小组拟以下列合成路线合成1-丁醇:
某学习小组拟以下列合成路线合成1-丁醇: