题目内容
7.将9.5gMgCl2溶于90g水中,溶液中Mg2+、Cl-、H2O粒子个数之比为1:2:50.分析 依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,结合氯化镁为强电解质,溶液中完全电离解答.
解答 解:9.5gMgCl2物质的量为:$\frac{9.5g}{95g/mol}$=0.1mol,氯化镁为强电解质完全电离,所以0.1mol氯化镁含有0.1mol镁离子和0.2mol氯离子;
90g水物质的量为$\frac{90g}{18g/mol}$=5mol;
依据依据n=$\frac{N}{{N}_{A}}$,N与n成正比,所以溶液中Mg2+、Cl-、H2O粒子个数之比为:0.1:0.2:5=1:2:50;
故答案为:1:2:50.
点评 本题考查了有关物质的量的计算,熟悉以物质的量为核心的计算公式,注意强电解质完全电离,题目难度不大.

练习册系列答案
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
7.可逆反应达到平衡状态的主要特征是( )
| A. | 正、逆反应的速率均为零 | B. | 正、逆反应都还在进行 | ||
| C. | 正、逆反应的速率相等 | D. | 反应停止了 |
18.下列关于钠的叙述中,不正确的是( )
| A. | 钠燃烧时生成氧化钠 | B. | 钠有很强的还原性 | ||
| C. | 钠原子的最外层只有一个电子 | D. | 钠燃烧时发出黄色火焰 |
15.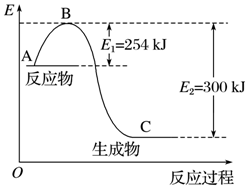 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol.
(2)若已知下列数据:
试根据表中及图中数据计算N-H的键能:390kJ•mol-1.
(3)用NH3催化还原NOx还可以消除氮氧化物的污染.已知:
4NH3(g)+3O2(g)═2N2+6H2O(g)△H1=-a kJ•mol-1①
N2(g)+O2(g)═2NO(g)△H2=-b kJ•mol-1②
求:若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=$\frac{3b-a}{4}$kJ•mol-1(用含a、b的式子表示).
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
请回答下列问题:
△H3与△H1、△H2之间的关系是△H3=2△H2-△H1.
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol.
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
(3)用NH3催化还原NOx还可以消除氮氧化物的污染.已知:
4NH3(g)+3O2(g)═2N2+6H2O(g)△H1=-a kJ•mol-1①
N2(g)+O2(g)═2NO(g)△H2=-b kJ•mol-1②
求:若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=$\frac{3b-a}{4}$kJ•mol-1(用含a、b的式子表示).
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
请回答下列问题:
△H3与△H1、△H2之间的关系是△H3=2△H2-△H1.
19.钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析.具体步骤如图所示:

①加入过量氨水后发生反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
②操作b为:过滤.
③Al(NO3)3待测液中,c(Al3+)=$\frac{1000m}{51v}$ mol/L(用含m、V的代数式表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示:

①根据表数据,请你判断该电池工作的适宜应控制在C(填字母)范围内.
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放电时,电极A为负极,电极B发生还原反应(填“氧化或还原”)
③充电时,总反应为Na2SX═2Na+xS(3<x<5),则阳极的电极反应式为:Sx2--2e-═xS.
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开.通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.则右侧发生的电极方程式:2H2O+2e-=H2↑+2OH-;试分析左侧溶液蓝色逐渐变浅的可能原因是:右侧溶液中生成的OH-通过阴离子交换膜进入左侧溶液,并与左侧溶液中I2反应.
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析.具体步骤如图所示:

①加入过量氨水后发生反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
②操作b为:过滤.
③Al(NO3)3待测液中,c(Al3+)=$\frac{1000m}{51v}$ mol/L(用含m、V的代数式表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示:

| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050、 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放电时,电极A为负极,电极B发生还原反应(填“氧化或还原”)
③充电时,总反应为Na2SX═2Na+xS(3<x<5),则阳极的电极反应式为:Sx2--2e-═xS.
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开.通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.则右侧发生的电极方程式:2H2O+2e-=H2↑+2OH-;试分析左侧溶液蓝色逐渐变浅的可能原因是:右侧溶液中生成的OH-通过阴离子交换膜进入左侧溶液,并与左侧溶液中I2反应.
14.某校化学兴趣小组采用酸碱中和滴定法测定学校新购入的烧碱的纯度(烧碱中含有不与酸反应的杂质),试根据实验回答.
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品.
②将样品配成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有250ml容量瓶,胶头滴管.
③用碱式滴定管量取10.00ml待测液,注入锥形瓶中.
④在锥形瓶中滴入2~3滴酚酞或甲基橙(填指示剂),用0.2010mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点.
(2)该小组测得下列数据
根据上述数据,计算烧碱的纯度98%.
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品.
②将样品配成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有250ml容量瓶,胶头滴管.
③用碱式滴定管量取10.00ml待测液,注入锥形瓶中.
④在锥形瓶中滴入2~3滴酚酞或甲基橙(填指示剂),用0.2010mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点.
(2)该小组测得下列数据
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
15.已知常温下,溶液中能发生如下反应:①2R-+Z2=R2+2Z-②16H++10Z-+2XO4-=2X2++5Z2+8H2O③2M2++2R2=2M3++2R-由此判断,下列说法中正确的是( )
| A. | Z2+2M2+=2 M3++2Z-不可以进行 | |
| B. | Z元素在①②反应中发生还原反应 | |
| C. | 各粒子还原性由强到弱的顺序是X2+>Z->R->M2+ | |
| D. | 各粒子氧化性由强到弱的顺序是XO4->Z2>R2>M3+ |