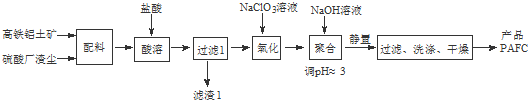
题目内容
6.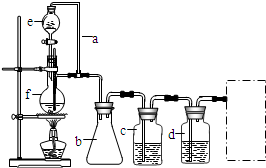 某学习小组拟以下列合成路线合成1-丁醇:
某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$\underset{\stackrel{{H}_{2}}{→}}{Ni△}$CH3CH2CH2CH2OH
已知:
①HCOOH$\underset{\stackrel{浓{H}_{2}S{O}_{4}}{→}}{△}$CO↑+H2O (HCOOH还原性强且易挥发)
②RCH=CH2$\underset{\stackrel{KMn{O}_{4}}{→}}{{H}^{+}}$RCOOH+CO2+H2O
请填写下列空白:
(1)仪器f的名称是蒸馏烧瓶.
(2)利用如图装置可以制备纯净干燥的CO,则a装置的作用是恒压,若无b装置可能产生的后果是液体倒吸.
(3)c、d用于除去CO中的杂质气体,c装置中发生反应的离子方程式为HCOOH+OH-=HCOO-+H2O.
(4)以2-丙醇为原料可以制备丙烯,化学反应方程式(CH3)2CHOH$→_{△}^{催化剂}$CH2=CHCH3↑+H2O .
在所得丙烯气体中还含有少量SO2、CO2及水蒸气.用以下试剂可以检验四种气体,则混合气体通过试剂的顺序依次是④⑤①③②(或④⑤①⑤②③) (填序号).
①饱和Na2SO3溶液;②酸性KMnO4溶液;③石灰水; ④无水CuSO4;⑤品红溶液
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品.为提纯1-丁醇,该小组设计出如下提纯路线:
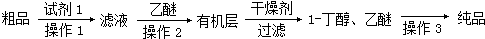
已知:①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓
②沸点:乙醚34℃,1-丁醇:118℃.
则操作2为萃取分液,操作3为蒸馏.
分析 CO的制备方法:HCOOH$→_{△}^{浓硫酸}$CO↑+H2O,在题给装置中,导管a平衡分液漏斗内压强,使分液漏斗内的液体浓硫酸顺利滴下,b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,还需用浓硫酸除去CO中的H2O,
(1)根据装置图中f的构造可知为蒸馏烧瓶;
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸,最后通过浓硫酸干燥CO,a的作用保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;b装置可作安全瓶,防止液体倒吸;
(3)c为除去CO中的酸性气体,选用NaOH溶液;
(4)制备丙烯选用2-丙醇和浓硫酸;检验丙烯和少量SO2、CO2及水蒸气组成的混合气体各成分时,应首先选④无水CuSO4检验水蒸气,然后用⑤品红溶液检验SO2,并用①饱和Na2SO3溶液除去SO2,然后用③石灰水检验CO2,再用②酸性KMnO4溶液检验丙烯;
(5)饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇;1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开.
解答 解:(1)根据装置图中f的构造可知为蒸馏烧瓶,
故答案为:蒸馏烧瓶;
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸,最后通过浓硫酸干燥CO,为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;b装置可作安全瓶,防止液体倒吸;
故答案为:恒压; 液体倒吸;
(3)c为除去CO中的酸性气体,选用NaOH溶液,反应的离子方程式为HCOOH+OH-=HCOO-+H2O,
故答案为:HCOOH+OH-=HCOO-+H2O;
(4)2-丙醇通过消去反应即到达丙烯,方程式为:(CH3)2CHOH$→_{△}^{催化剂}$CH2=CHCH3↑+H2O,检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液褪色、品红溶液或石灰水,检验CO2可以石灰水,检验水蒸气可以无水CuSO4,所以在检验这四种气体必需考虑试剂的选择和顺序.只要通过溶液,就会产生水蒸气,因此先检验水蒸气;然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,最后检验CO2和丙烯,因此顺序为④⑤①③②(或④⑤①⑤②③),
故答案为:(CH3)2CHOH$→_{△}^{催化剂}$CH2=CHCH3↑+H2O;④⑤①③②(或④⑤①⑤②③);
(5)饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇,所以操作2为萃取分液;1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开,所以操作1为 过滤,操作2为 萃取分液,操作3为蒸馏,
故答案为:萃取分液;蒸馏.
点评 本题考查有机物合成方案的设计,题目难度较大,综合性较强,答题时注意把握物质的分离、提纯方法,把握物质的性质的异同是解答该题的关键.

| A. | 钠燃烧时生成氧化钠 | B. | 钠有很强的还原性 | ||
| C. | 钠原子的最外层只有一个电子 | D. | 钠燃烧时发出黄色火焰 |
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析.具体步骤如图所示:

①加入过量氨水后发生反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
②操作b为:过滤.
③Al(NO3)3待测液中,c(Al3+)=$\frac{1000m}{51v}$ mol/L(用含m、V的代数式表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示:

| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050、 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放电时,电极A为负极,电极B发生还原反应(填“氧化或还原”)
③充电时,总反应为Na2SX═2Na+xS(3<x<5),则阳极的电极反应式为:Sx2--2e-═xS.
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开.通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.则右侧发生的电极方程式:2H2O+2e-=H2↑+2OH-;试分析左侧溶液蓝色逐渐变浅的可能原因是:右侧溶液中生成的OH-通过阴离子交换膜进入左侧溶液,并与左侧溶液中I2反应.
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品.
②将样品配成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有250ml容量瓶,胶头滴管.
③用碱式滴定管量取10.00ml待测液,注入锥形瓶中.
④在锥形瓶中滴入2~3滴酚酞或甲基橙(填指示剂),用0.2010mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点.
(2)该小组测得下列数据
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
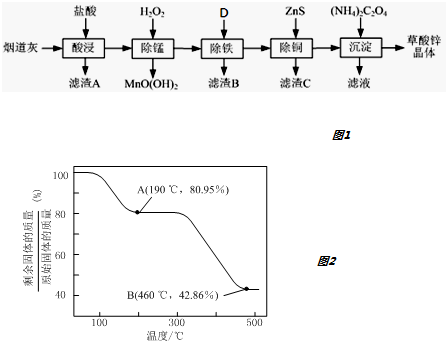
(1)滤渣A的主要成分为SiO2.为了提高浸出速率,除将烟道灰处理得更细外,还可采取的措施有适当增加盐酸的浓度、提高反应温度、搅拌(写出两条).
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入的物质D最好是ZnO或ZnCO3或Zn(OH)2.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是将Na2C2O4缓慢加入到ZnCl2溶液中,边加边搅拌.
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图2所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.
| A. | 做焰色反应实验用的铂丝要用受热容易挥发的稀盐酸洗涤 | |
| B. | 观察K2SO4的焰色应透过蓝色的钴玻璃 | |
| C. | 可以用焰色反应来区别NaCl溶液和KCl溶液 | |
| D. | 焰色反应一定是化学变化 |
| A. | Z2+2M2+=2 M3++2Z-不可以进行 | |
| B. | Z元素在①②反应中发生还原反应 | |
| C. | 各粒子还原性由强到弱的顺序是X2+>Z->R->M2+ | |
| D. | 各粒子氧化性由强到弱的顺序是XO4->Z2>R2>M3+ |
| A. | MnO2→MnSO4 | B. | KI→KIO3 | C. | HNO 3→NO | D. | Al2O 3→Al(OH)3 |