题目内容
5.在无色、碱性溶液中能大量共存的一组离子是( )| A. | Ca2+、Na+、SO42-、CO32- | B. | K+、Fe2+、SO42-、MnO4- | ||
| C. | Ba2+、K+、Al3+、Cl- | D. | Na+、Ba2+、Cl-、NO3- |
分析 无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,碱性溶液中存在大量氢氧根离子,
A.钙离子与硫酸根离子、碳酸根离子反应;
B.亚铁离子、高锰酸根离子为有色离子,亚铁离子与氢氧根离子反应;
C.铝离子与氢氧根离子反应;
D.四种离子之间不反应,都是无色离子,都不与氢氧根离子反应.
解答 解:无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,碱性溶液中存在大量氢氧根离子,
A.Ca2+与SO42-、CO32-发生反应,在溶液中不能大量共存,故A错误;
B.Fe2+、MnO4-为有色离子,Fe2+与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.Al3+与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.Na+、Ba2+、Cl-、NO3-之间不反应,都不与氢氧根离子反应,且为无色溶液,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;试题侧重对学生基础知识的训练和检验,有利于培养学生的灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
15.已知常温下,溶液中能发生如下反应:①2R-+Z2=R2+2Z-②16H++10Z-+2XO4-=2X2++5Z2+8H2O③2M2++2R2=2M3++2R-由此判断,下列说法中正确的是( )
| A. | Z2+2M2+=2 M3++2Z-不可以进行 | |
| B. | Z元素在①②反应中发生还原反应 | |
| C. | 各粒子还原性由强到弱的顺序是X2+>Z->R->M2+ | |
| D. | 各粒子氧化性由强到弱的顺序是XO4->Z2>R2>M3+ |
16.需要加入氧化剂才能实现的变化是( )
| A. | MnO2→MnSO4 | B. | KI→KIO3 | C. | HNO 3→NO | D. | Al2O 3→Al(OH)3 |
13. 25℃时,三种酸的电离平衡常数如表:
25℃时,三种酸的电离平衡常数如表:
(1)常温下,若三者体积均为200mL 浓度均为0.1mol•L-1,则三者中C(H+)最小的是次氯酸(填名称).
(2)相同条件下,体积均为200mL、浓度均为0.1mol•L-1的CH3COOH(aq)和HCl(aq)分别与100mL 0.2mol•L-1NaOH溶液反应,放出热量较少的是醋酸 (填名称).
(3)下列四种离子结合质子能力由大到小的顺序是a>b>d>c(填序号).
a.CO32-b.ClO- c.CH3COO-d.HCO3-
(4)向次氯酸钠溶液中通入少量二氧化碳,写出该过程中反应的离子方程式:ClO-+CO2+H2O=HCO3-+HClO.
(5)在一定温度下,有 a.盐酸 b.硫酸 c.醋酸三种酸,当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为a=b=c(填序号),反应所需时间的长短关系是a=b>c(填序号).
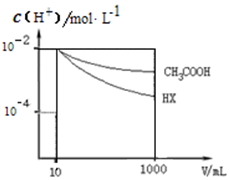
(6)相同条件下,体积均为10mL、c(H+)为0.01mol•L-1的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中c(H+)变化如图所示.
则HX的电离平衡常大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数.
 25℃时,三种酸的电离平衡常数如表:
25℃时,三种酸的电离平衡常数如表:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(2)相同条件下,体积均为200mL、浓度均为0.1mol•L-1的CH3COOH(aq)和HCl(aq)分别与100mL 0.2mol•L-1NaOH溶液反应,放出热量较少的是醋酸 (填名称).
(3)下列四种离子结合质子能力由大到小的顺序是a>b>d>c(填序号).
a.CO32-b.ClO- c.CH3COO-d.HCO3-
(4)向次氯酸钠溶液中通入少量二氧化碳,写出该过程中反应的离子方程式:ClO-+CO2+H2O=HCO3-+HClO.
(5)在一定温度下,有 a.盐酸 b.硫酸 c.醋酸三种酸,当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为a=b=c(填序号),反应所需时间的长短关系是a=b>c(填序号).
(6)相同条件下,体积均为10mL、c(H+)为0.01mol•L-1的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中c(H+)变化如图所示.
则HX的电离平衡常大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数.
10.根据生活经验,判断下列物质按酸碱性的一定顺序依次排列正确的是( )
| A. | 厕所清洁剂 厨房清洁剂 醋 肥皂 | |
| B. | 醋 厕所清洁剂 厨房清洁剂 肥皂 | |
| C. | 厕所清洁剂 醋 肥皂 厨房清洁剂 | |
| D. | 厨房清洁剂 厕所清洁剂 肥皂 醋 |
17.某反应CH3OH(l)+NH3(g)?CH3NH2(g)+H2O(g)在高温度时才能自发进行,则该反应过程的△H、△S判断正确的是( )
| A. | △H>0、△S<0 | B. | △H>0、△S>0 | C. | △H<0、△S<0 | D. | △H<0、△S>0 |