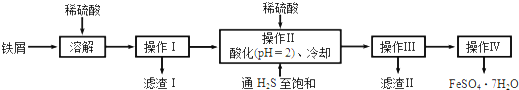
题目内容
17.比较下列溶液的pH大小(填“>”、“<”或“=”):(1)0.1mol/L NH4Cl溶液<0.01mol/L NH4Cl溶液;
(2)0.1mol/L Na2CO3溶液>0.1mol/L NaHCO3溶液;
(3)25℃时 1mol/L FeCl3溶液>80℃时 1mol/L FeCl3溶液;
(4)0.1mol/L (NH4)2CO3溶液<0.1mol/L Na2CO3溶液.
分析 (1)铵根离子水解溶液呈酸性,铵根离子浓度越大,溶液中氢离子浓度越大,溶液的pH越小;
(2)碳酸根离子的水解程度程度大于碳酸氢根离子离子;
(3)铁离子水解溶液显示酸性,温度越高,铁离子浓度越大,水解生成的氢离子浓度越大,溶液的pH越小;
(4)铵根离子水解呈酸性,碳酸根离子水解呈碱性,铵根离子水解生成氢离子导致溶液中氢氧根离子浓度减小,溶液的pH减小.
解答 解:(1)0.1mol/L NH4Cl溶液浓度大于0.01mol/L NH4Cl溶液,则前者溶液中铵根离子水解生成氢离子浓度较大,其溶液pH减小,
故答案为:<;
(2)0.1mol/L Na2CO3溶液、0.1mol/L NaHCO3溶液中,由于碳酸根离子的水解程度大于碳酸氢根离子,则浓度相等的碳酸钠溶液中氢氧根离子浓度大于碳酸氢钠,碳酸钠溶液的pH大于碳酸氢钠,
故答案为:>;
(3)25℃时 1mol/L FeCl3溶液、80℃时 1mol/L FeCl3溶液,温度越高,铁离子的水解程度越大,则后者溶液中铁离子水解程度较大,其溶液中氢离子浓度较大,溶液pH减小,
故答案为:>;
(4)0.1mol/L (NH4)2CO3溶液、0.1mol/L Na2CO3溶液,前者溶液中铵根离子水解溶液呈酸性,中和了部分碳酸根离子水解生成的氢氧根离子,导致前者溶液的pH小于后者,
故答案为:<.
点评 本题考查了盐的水解原理及其应用,题目难度中等,明确盐的水解原理为解答关键,注意掌握影响盐的水解平衡的因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.下列推理正确的是( )
| A. | 铝粉在氧气中燃烧生成Al2O3,故钠在氧气中燃烧生成Na2O | |
| B. | 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜 | |
| C. | 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中 | |
| D. | 钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂 |
8.设NA表示阿伏伽德罗常数的值,下列说法中,正确的是( )
| A. | 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA | |
| B. | 1molAl3+含有核外电子数为3NA | |
| C. | 常温常压下,1mol氧气所含的原子数为NA | |
| D. | 1molNaCl晶体中含有NA个Na+和NA个Cl |
2.将一小块新切的不规则形状的金属钠投入到滴有酚酞溶液的水中,观察到下列现象,其中可说明钠与水反应放出气体的现象是( )
| A. | 金属钠浮在水面上 | B. | 金属钠形成小球状 | ||
| C. | 金属钠在水面上迅速游动 | D. | 反应后的溶液呈现红色 |
9.某化工生产反应历程的能量变化如图所示,过程1没有使用催化剂,过程2使用催化剂,则可判断催化剂除了改变反应速率之外,还可以改变的是( )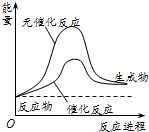

| A. | 反应物的状态 | B. | 反应的完成程度 | C. | 生产能耗 | D. | 反应热效应 |
6.由于Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3,如图图所示中能较长时间看到Fe(OH)2白色沉淀的是( )
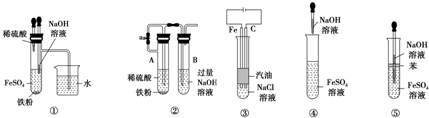

| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②③④⑤ | D. | ③⑤ |
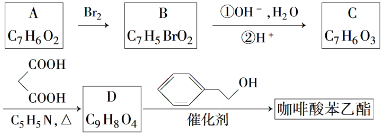
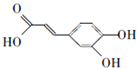 ;
;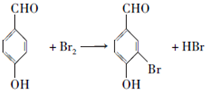 ;
;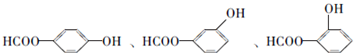 .a.属于酯类 b.能发生银镜反应 c.与FeCl3溶液发生显色反应①
.a.属于酯类 b.能发生银镜反应 c.与FeCl3溶液发生显色反应①