题目内容
2.将一小块新切的不规则形状的金属钠投入到滴有酚酞溶液的水中,观察到下列现象,其中可说明钠与水反应放出气体的现象是( )| A. | 金属钠浮在水面上 | B. | 金属钠形成小球状 | ||
| C. | 金属钠在水面上迅速游动 | D. | 反应后的溶液呈现红色 |
分析 A、金属钠浮于水上是体现的是钠与水的密度.;
B、体现的是钠的熔点;
C、金属钠与水反应生成气体,导致钠的游动;
D、体现的是生成物的水溶液呈碱性.
解答 解:A、金属钠浮于水上是体现的是钠与水的密度,与生成气体无关,故A错误;
B、体现的是钠的熔点较低,与生成气体无关,故B错误;
C、金属钠与水反应生成气体,导致钠的游动,与生成气体有关,故C正确;
D、反应后的溶液呈现红色体现了生成物的水溶液呈碱性,故D错误;
故选C.
点评 本题考查了钠与水的反应实验,难度不大,明确反应的现象对应的化学原理是关键,注意基础知识的积累.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
12.如图是某校实验小组设计的一套原电池装置,下列有关描述不正确的是( )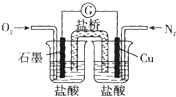

| A. | 石墨的电极反应:O2+2H20+4e-═4OH- | |
| B. | 此装置能将化学能转变为电能 | |
| C. | 电子由Cu电极经导线流向石墨电极 | |
| D. | 电池总反应:2Cu+O2+4HCl═2CuCl2+2H20 |
13.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2 L氧气所含的分子数为NA | |
| B. | 1.8 g 的NH4+中含有的电子数为NA | |
| C. | 常温常压下,48 g O3含有的氧原子数为NA | |
| D. | 24 g金属镁变为镁离子时失去的电子数为NA |
14.下列说法正确的是( )
| A. | 有单质生成的反应一定是氧化还原反应 | |
| B. | 分解反应和复分解反应都不是氧化还原反应 | |
| C. | 氧化还原反应中一定有电子发生转移 | |
| D. | 置换反应也有可能是非氧化还原反应 |
11.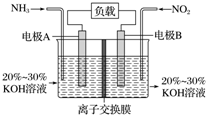 利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
 利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )| A. | 电子从右侧电极经过负载后流向左侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 当有4.48 L NH3 (标准状况)反应时,转移电子为0.6 mol |
12.科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 该原子的摩尔质量是aNA | |
| B. | Wg该原子的物质的量一定是$\frac{W}{a{N}_{A}}$mol | |
| C. | Wg该原子中含有$\frac{W}{a}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{12}{b}$ |