题目内容
6.由于Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3,如图图所示中能较长时间看到Fe(OH)2白色沉淀的是( )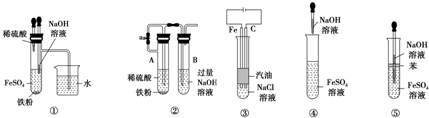
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②③④⑤ | D. | ③⑤ |
分析 氢氧化亚铁能够与空气中氧气发生反应4Fe(OH)2+O2+2H2O=4Fe(OH)3,要较长时间保存Fe(OH)2沉淀,只要满足在制取过程中尽可能减少和空气接触即可,据此对各选项进行判断.
解答 解:根据题中信息可知要较长时间保存Fe(OH)2沉淀,必须在制取过程中尽可能减少和空气接触,
对比5个实验明显可以发现选项③、⑤加入有机物作隔离层和空气接触少,②中Fe和稀硫酸生成氢气能排出装置中的氧气,所以也能减少与氧气接触,①中盛有氢氧化钠溶液的滴管伸入放有还原性铁粉的硫酸亚铁溶液中,可以避免试管中部分氧气对氢氧化亚铁的氧化,则能减少与氧气接触;
只有④生成的氢氧化亚铁能够与空气中氧气发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,导致不能长时间观察到氢氧化亚铁,
①②③⑤正确,
故选B.
点评 本题考查了氢氧化亚铁的制取,题目难度中等,氢氧化亚铁极易被氧气氧气,所以制取氢氧化亚铁时注意必须在无氧气条件下进行反应,这是高中化学中较重要的一个实验,是学习重点,注意熟练掌握反应方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.

练习册系列答案
相关题目
16.下列检验某溶液中所含离子的实验方案正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
14.下列说法正确的是( )
| A. | 有单质生成的反应一定是氧化还原反应 | |
| B. | 分解反应和复分解反应都不是氧化还原反应 | |
| C. | 氧化还原反应中一定有电子发生转移 | |
| D. | 置换反应也有可能是非氧化还原反应 |
1.下列说法正确的是( )
| A. | 按系统命名法,化合物CH3CH(C2H5)CH(C2H5)CH(CH3)2的名称是2-甲基-3,4-二乙基戊烷 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也不存在同分异构体 | |
| D. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 |
11.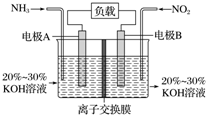 利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
 利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )| A. | 电子从右侧电极经过负载后流向左侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 当有4.48 L NH3 (标准状况)反应时,转移电子为0.6 mol |
18.下列反应无论在低温还是高温下均为非自发反应的是( )
| A. | 2Ag2O(s)═4Ag (s)+O2(g) | B. | 2CO2(g)═2CO(g)+O2 (g) | ||
| C. | 6C(s)+6 H2O(l)═C6H12O6 (s) | D. | CaCO3(s)═CaO(s)+2CO2(g) |
15.图是实验室制备氯气并进行一系列相关实验的装置.
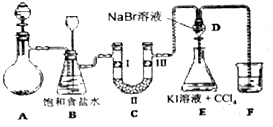
(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D.
(4)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱,当向D中缓慢通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,下层(CCl4层)为紫红色,该现象不能(填“能”或“不能”)说明Br2的氧化性强于I2.
(5)多余的Cl2用氢氧化钠吸收的离子方程式为Cl2+2OH-=ClO-+H2O.

(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D.
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)多余的Cl2用氢氧化钠吸收的离子方程式为Cl2+2OH-=ClO-+H2O.
16.下列叙述正确的是( )
| A. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 | |
| B. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 一氧化碳气体和氮气,若体积相等,则质量一定相等 |