题目内容
7.下列推理正确的是( )| A. | 铝粉在氧气中燃烧生成Al2O3,故钠在氧气中燃烧生成Na2O | |
| B. | 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜 | |
| C. | 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中 | |
| D. | 钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂 |
分析 A.钠在氧气中燃烧生成过氧化钠;
B.钠与盐溶液反应时,先与水反应;
C.Al在空气中能形成致密的氧化膜;
D.金属单质的化合价为最低价.
解答 解:A.钠在氧气中燃烧生成过氧化钠,钠在常温下与氧气反应生成Na2O,故A错误;
B.钠与盐溶液反应时,先与水反应,所以钠与硫酸铜溶液中的水反应生成NaOH,NaOH与硫酸铜反应生成氢氧化铜沉淀,所以Na不能从硫酸铜溶液中置换出铜,故B错误
C.Al在空气中能形成致密的氧化膜,致密的氧化膜能保护内部金属,所以Al可以直接放在空气中,故C错误;
D.金属单质的化合价为最低价,最低价只有还原性,所以金属单质参与反应时金属单质均作还原剂,故D正确.
故选D.
点评 本题考查了金属的性质,注意把握常见金属的性质如Na、Mg、Al、Fe等的性质,题目难度不大,侧重于基础知识的考查.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列说法正确的是( )
| A. | 12C、13C和14C互为同位素,他们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| B. | 合成纤维是利用自然界的纤维材料通过化学合成方法得到的 | |
| C. | 研制出性能优良的催化剂可以使反应的温度降低,从而起到很好的节能效果 | |
| D. | 碰撞理论和过度态理论是常用的化学反应速率理论,其中过渡态理论可解释温度、浓度等对化学反应速率的影响 |
18.若锌与稀硝酸反应时,其化学反应方程式为:4Zn+10HNO3=aZn(NO3)2+bM+cH2O,则a、b、c、M可能分别为( )
| A. | 4、1、5、NO2 | B. | 4、2、4、NO2 | C. | 4、1、3、NH4NO3 | D. | 4、3、5、NO |
2.下列有关说法中,不正确的是( )
| A. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| B. | SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱 | |
| C. | 根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液 | |
| D. | 焰火的五彩缤纷是某些金属元素的性质的表现 |
12.如图是某校实验小组设计的一套原电池装置,下列有关描述不正确的是( )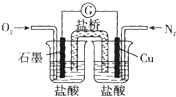

| A. | 石墨的电极反应:O2+2H20+4e-═4OH- | |
| B. | 此装置能将化学能转变为电能 | |
| C. | 电子由Cu电极经导线流向石墨电极 | |
| D. | 电池总反应:2Cu+O2+4HCl═2CuCl2+2H20 |
19.如图是甲醇燃料电池工作的示意图1,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2,则下列说法错误的是( )
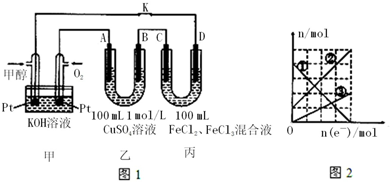

| A. | 负极的电极反应式是:CH3OH-6e-+8OH-═CO32-+6H2O | |
| B. | 乙中A极析出的气体在标准状况下的体积为1.12 L | |
| C. | 右图中②线表示的是Fe2+离子的变化 | |
| D. | 反应结束后,要使丙装置溶液中金属阳离子恰好完全沉淀,需要280 mL 5.0 mol/L NaOH溶液 |
16.下列检验某溶液中所含离子的实验方案正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |