题目内容
12.以锌片和铜片为电极,以稀硫酸为电解质溶液的原电池中,当导线中通过2mol电子时,下列说法正确的是( )| A. | 锌片溶解了1 mol,铜片上析出1 mol氢气 | |
| B. | 两极溶解和析出的物质的质量相等 | |
| C. | 锌片溶解了1 g,铜片上析出1 g氢气 | |
| D. | 锌片溶解了1 mol,硫酸消耗了2mol |
分析 锌片、铜片和稀硫酸构成原电池,较活泼的金属Zn作负极,铜作正极,负极反应为Zn-2e-=Zn2+,发生氧化反应;正极上氢离子得电子发生氢气,发生还原反应,以此来解答.
解答 解:A.负极反应为Zn-2e-=Zn2+,正极反应为2H++2e-=H2↑,转移2mol电子溶解1molZn,且生成1molH2,故A正确;
B.由选项A可知,转移2mol电子,溶解的Zn与生成氢气的物质的量相同,但是质量不相等,故B错误;
C.负极反应为Zn-2e-=Zn2+,正极反应为2H++2e-=H2↑,转移2mol电子溶解1molZn,且生成1molH2,则锌片溶解了65g,铜片上析出了2g H2,故C错误;
D.由Zn+2H+=H2↑+Zn2+,可知,锌片溶解了1mol,消耗1mol硫酸,故D错误;
故选A.
点评 本题考查了原电池原理,把握发生的电极反应、电池总反应及物质的量的关系为解答本题的关键,侧重原电池工作原理的考查,题目难度不大.

练习册系列答案
相关题目
2.下列反应后只可能生成一种有机物的是( )
| A. | CH3-CH=CH2与HCl加成 | B. |  在浓硫酸存在下,发生分子内脱水 在浓硫酸存在下,发生分子内脱水 | ||
| C. |  在铁粉存在下与液溴反应 在铁粉存在下与液溴反应 | D. |  在浓硫酸存在下,发生分子内脱水 在浓硫酸存在下,发生分子内脱水 |
3.用VSEPR 理论判断:
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的形状 |
| NH4+ | 1 | sp3 | 三角锥形 |
| NCl3 | 0 | sp3 | 正四面体形 |
20.在5L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)?N2(g)+2CO2(g).起始反应时NO和CO各为3mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1mol.下列有关反应速率的说法中,正确的是( )
| A. | 达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小 | |
| B. | 反应前5秒钟内,用CO表示的平均反应速率为0.04 mol•L-1•s-1 | |
| C. | 当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变 | |
| D. | 保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变 |
7.下列各组中两个化学反应,属于同一反应类型的一组是( )
| A. | 由苯制硝基苯;由苯制环己烷 | |
| B. | 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷 | |
| C. | 由苯制溴苯;CH4制CH2Cl2 | |
| D. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 |
17.标准状况下1mol烃完全燃烧时,生成89.6L CO2,又知0.1mol此烃能与标准状况下4.48L H2加成,则此烃的结构简式是( )
| A. | CH3CH2CH2CH3 | B. | CH3-C≡C-CH3 | ||
| C. | CH3CH2CH═CH2 | D. | CH2═CH-CH═CH-CH3 |
4.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑.以下解决能源问题的方法不当的是( )
| A. | 用木材作燃料 | B. | 用乙醇替代汽油 | C. | 开发风能 | D. | 开发地热 |
2.类比的思维方式在化学学习与研究中经常采用,但类比得到的结论是否正确最终要经过实验的验证.以下类比的结论正确的是( )
| A. | Na、K都是I A族的金属,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 | |
| B. | HCl的水溶液是强酸,推出HF的水溶液也是强酸 | |
| C. | 由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生 | |
| D. | 由“Cl2+H2O?HCl+HClO”反应可推出“F2+H2O?HF+HFO”反应也能发生 |
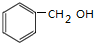
 ,该反应用于苯酚的定性检验和定量测定.
,该反应用于苯酚的定性检验和定量测定.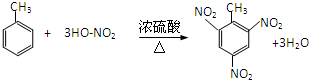 .
.