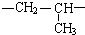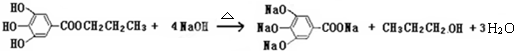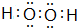题目内容
3.用VSEPR 理论判断:| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的形状 |
| NH4+ | 1 | sp3 | 三角锥形 |
| NCl3 | 0 | sp3 | 正四面体形 |
分析 根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数,据此判断杂质类型以及立体结构.
解答 解:NH4+中氮原子杂化轨道数=4+$\frac{1}{2}$(5-1-3×1)=4+0=4,含孤电子对数为0,杂化轨道数4,采取sp3杂化,分子形状为正四面体形;
NCl3中价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4,含孤电子对数为1,杂化轨道数4,所以原子杂化方式是sp3,分子形状为三角锥形;
故答案为:
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的形状 |
| NH4+ | 1 | sp3 | 三角锥形 |
| NCl3 | 0 | sp3 | 正四面体形 |
点评 本题考查了原子杂化方式的判断和微粒的空间构型的判断,根据价层电子对互斥理论来分析解答,注意孤电子对个数的计算方法,为易错,题目难度中等.

练习册系列答案
相关题目
11.下列各组顺序的排列不正确的是( )
| A. | 离子半径:Na+>Mg2+>Al3+>F- | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:SiO2>NaCl>I2>CO2 |
18.下列各对物质中,一定互为同系物的是( )
| A. | C4H8、C2H4 | B. | CH4、C2H5OH | C. | C2H6、C3H8 | D. | CH3COOH、C3H8 |
15.如表列出了A~R十二种元素在周期表中的位置:
请用相应的化学符号和化学用语回答下列问题:
(1)其中单质化学性质最不活泼的元素是Ar,最活泼的金属元素是K;
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH;其中J与F按原子个数1:1所成的化合物的电子式为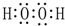 .
.
(3)A、B、C三种元素按离子半径由大到小的顺序排列为K+>Na+>Mg2+;
(4)元素G的气态氢化物比元素H的气态氢化物稳定(填“稳定”或“不稳定”).元素K和I的气态氢化物沸点较高的是NH3(填化学式).其原因是氨气分子之间存在氢键.
(5)元素G的单质溶于元素A的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的化学式为NaClO,该化合物中所含的化学键类型为离子键、共价键.
(6)元素B、C、D的简单阳离子的氧化性比较Al3+>Mg2+>Na+.(填离子符号)
(7)1g元素J的单质完全燃烧生成液态氧化物时放出的热量为142.9KJ,写出元素J的单质燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
(1)其中单质化学性质最不活泼的元素是Ar,最活泼的金属元素是K;
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH;其中J与F按原子个数1:1所成的化合物的电子式为
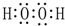 .
.(3)A、B、C三种元素按离子半径由大到小的顺序排列为K+>Na+>Mg2+;
(4)元素G的气态氢化物比元素H的气态氢化物稳定(填“稳定”或“不稳定”).元素K和I的气态氢化物沸点较高的是NH3(填化学式).其原因是氨气分子之间存在氢键.
(5)元素G的单质溶于元素A的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的化学式为NaClO,该化合物中所含的化学键类型为离子键、共价键.
(6)元素B、C、D的简单阳离子的氧化性比较Al3+>Mg2+>Na+.(填离子符号)
(7)1g元素J的单质完全燃烧生成液态氧化物时放出的热量为142.9KJ,写出元素J的单质燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
12.以锌片和铜片为电极,以稀硫酸为电解质溶液的原电池中,当导线中通过2mol电子时,下列说法正确的是( )
| A. | 锌片溶解了1 mol,铜片上析出1 mol氢气 | |
| B. | 两极溶解和析出的物质的质量相等 | |
| C. | 锌片溶解了1 g,铜片上析出1 g氢气 | |
| D. | 锌片溶解了1 mol,硫酸消耗了2mol |
13.下列说法错误的是( )
| A. | H2O比H2S稳定,是因为H2O分子间存在氢键 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | 锂所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3 | |
| D. | I的原子半径大于Br,HBr比HI的热稳定性强 |

 (其中:-X、-Y均为官能团)
(其中:-X、-Y均为官能团)