题目内容
7.下列各组中两个化学反应,属于同一反应类型的一组是( )| A. | 由苯制硝基苯;由苯制环己烷 | |
| B. | 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷 | |
| C. | 由苯制溴苯;CH4制CH2Cl2 | |
| D. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 |
分析 A.苯中H被硝基取代;苯与氢气发生加成反应生成环己烷;
B.乙烯与溴发生加成反应生成1,2-二溴乙烷;由乙烷与氯气光照下发生取代反应生成一氯乙烷;
C.苯中H被溴取代;甲烷中H被Cl取代;
D.乙烯与溴水发生加成反应;乙烯被高锰酸钾氧化.
解答 解:A.苯中H被硝基取代;苯与氢气发生加成反应生成环己烷,则分别发生取代反应、加成反应,故A不选;
B.乙烯与溴发生加成反应生成1,2-二溴乙烷;由乙烷与氯气光照下发生取代反应生成一氯乙烷,则分别发生加成反应、取代反应,故B不选;
C.苯中H被溴取代;甲烷中H被Cl取代,均发生取代反应,故C选;
D.乙烯与溴水发生加成反应;乙烯被高锰酸钾氧化,分别发生加成反应、氧化反应,故D不选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物官能团与性质的关系为解答关键,注意有机反应的判断,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
18.下列各对物质中,一定互为同系物的是( )
| A. | C4H8、C2H4 | B. | CH4、C2H5OH | C. | C2H6、C3H8 | D. | CH3COOH、C3H8 |
15.如表列出了A~R十二种元素在周期表中的位置:
请用相应的化学符号和化学用语回答下列问题:
(1)其中单质化学性质最不活泼的元素是Ar,最活泼的金属元素是K;
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH;其中J与F按原子个数1:1所成的化合物的电子式为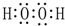 .
.
(3)A、B、C三种元素按离子半径由大到小的顺序排列为K+>Na+>Mg2+;
(4)元素G的气态氢化物比元素H的气态氢化物稳定(填“稳定”或“不稳定”).元素K和I的气态氢化物沸点较高的是NH3(填化学式).其原因是氨气分子之间存在氢键.
(5)元素G的单质溶于元素A的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的化学式为NaClO,该化合物中所含的化学键类型为离子键、共价键.
(6)元素B、C、D的简单阳离子的氧化性比较Al3+>Mg2+>Na+.(填离子符号)
(7)1g元素J的单质完全燃烧生成液态氧化物时放出的热量为142.9KJ,写出元素J的单质燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
(1)其中单质化学性质最不活泼的元素是Ar,最活泼的金属元素是K;
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH;其中J与F按原子个数1:1所成的化合物的电子式为
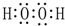 .
.(3)A、B、C三种元素按离子半径由大到小的顺序排列为K+>Na+>Mg2+;
(4)元素G的气态氢化物比元素H的气态氢化物稳定(填“稳定”或“不稳定”).元素K和I的气态氢化物沸点较高的是NH3(填化学式).其原因是氨气分子之间存在氢键.
(5)元素G的单质溶于元素A的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的化学式为NaClO,该化合物中所含的化学键类型为离子键、共价键.
(6)元素B、C、D的简单阳离子的氧化性比较Al3+>Mg2+>Na+.(填离子符号)
(7)1g元素J的单质完全燃烧生成液态氧化物时放出的热量为142.9KJ,写出元素J的单质燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
2.关于铅蓄电池Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O的说法不正确的是( )
| A. | 放电时,正极发生的反应是Pb+SO42-+2e-═PbSO4 | |
| B. | 放电时,该电池的负极材料是铅板 | |
| C. | 放电时,电池中硫酸的浓度不断变小 | |
| D. | 放电时,每当消耗1 mol铅时转移电子2 mol |
12.以锌片和铜片为电极,以稀硫酸为电解质溶液的原电池中,当导线中通过2mol电子时,下列说法正确的是( )
| A. | 锌片溶解了1 mol,铜片上析出1 mol氢气 | |
| B. | 两极溶解和析出的物质的质量相等 | |
| C. | 锌片溶解了1 g,铜片上析出1 g氢气 | |
| D. | 锌片溶解了1 mol,硫酸消耗了2mol |
16.某学生做乙醛的还原性实验时,取1mol/L CuSO4溶液和0.5mol/L NaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入0.5mL40%的乙醛,加热,结果无红色沉淀出现.导致该实验失败的原因可能是( )
| A. | 加入NaOH溶液的量不够 | B. | 加入乙醛太少 | ||
| C. | 加入CuSO4溶液的量不够 | D. | 加入乙醛的量太多 |

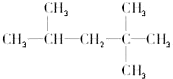 现有化合物A是汽油燃烧抗震性能的参照物,它的结构式如图:
现有化合物A是汽油燃烧抗震性能的参照物,它的结构式如图: