题目内容
16.某化学小组在实验室制取Na2O2.查阅资料可知:钠与空气在453~473K之间可生成Na2O,迅速提高温度到573~673K之间可生成Na2O2,若温度提高到733~873K之间Na2O2可分解.除Li外其他碱金属不与N2反应.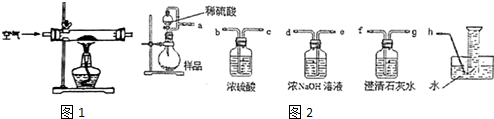
(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液加入少量Mn02粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2〜3滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2〜3滴酚酞试液,充分振荡,然后逐 滴加入过量的NaOH稀溶液 | 开始无明显现象.加NaOH溶 液先变红后褪色 |
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].
分析 (1)①钠与氧气反应可以得到氧化钠、过氧化钠,二者均与二氧化碳反应得到碳酸钠,与水反应会得到氢氧化钠,由信息可知钠与氮气不反应,而碳酸氢钠受热分解;
②烧瓶中过氧化钠与硫酸反应生成硫酸钠、氧气与水,分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,还可以抵消滴加硫酸排出空气的体积;用浓氢氧化钠溶液吸收可能氧气中混有二氧化碳,澄清石灰水检验二氧化碳是否除尽,用排水法收集氧气,根据氧气体积可以计算过氧化钠的质量,进而计算样品中过氧化钠的质量分数;
(2)实验I说明中间产物为过氧化氢,且过氧化氢没有完全分解为氧气,导致测定氧气体积偏小;
实验Ⅱ:反应后的溶液中有硫酸剩余,可以使红色酚酞溶液褪色;
实验Ⅲ:加入的氢氧化钠先中和剩余的硫酸,过量的氢氧化钠式溶液显红色,过氧化氢具有强氧化性,又使溶液红色褪去;
(3)称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算,或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.
解答 解:(1)①钠与氧气反应可以得到氧化钠、过氧化钠,二者均与二氧化碳反应得到碳酸钠,与水反应会得到氢氧化钠,由信息可知钠与氮气不反应,而碳酸氢钠受热分解,Na2O2中可能含有的杂质为Na2CO3、Na2O、NaOH,
故答案为:bcd;
②烧瓶中过氧化钠与硫酸反应生成硫酸钠、氧气与水,反应方程式为:2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O,
分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,还可以抵消滴加硫酸排出空气的体积,若没有该导管,排出的空气按生成氧气的体积计算,导致测定氧气体积偏大,则测定Na2O2样品的纯度偏大,
用浓氢氧化钠溶液吸收可能氧气中混有二氧化碳,澄清石灰水检验二氧化碳是否除尽,用排水法收集氧气,根据氧气体积可以计算过氧化钠的质量,进而计算样品中过氧化钠的质量分数,测定装置的接口从左至右正确的连接顺序是aedfgh,
故答案为:2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O;偏大;aedfgh;
(2)实验I说明中间产物为过氧化氢,且过氧化氢没有完全分解为氧气,导致测定氧气体积偏小,从而导致测定结果偏小;
实验Ⅱ:反应后的溶液中有硫酸剩余,可以使红色酚酞溶液褪色;
实验Ⅲ:加入的氢氧化钠先中和剩余的硫酸,过量的氢氧化钠式溶液显红色,过氧化氢具有强氧化性,又使溶液红色褪去,反应溶液中存在的中间产物与酚酞作用的条件是碱性条件,
故答案为:偏小;I;碱性条件;
(3)称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.]
故答案为:称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.].
点评 本题考查物质制备实验、物质含量测定、探究实验等,侧重考查学生对测定原理的理解分析,注意定量实验中准确性问题.

(1)基态碳原子核外有6种空间运动状态的电子,其价电子排布图为
 .
.(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为平面三角形,其碳原子杂化轨道类型为sp2杂化.
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
(4)碳的一种同素异形体--C60,又名足球烯,是一种高度对称的球碳分子.立方烷(分子式:C8H8结构是立方体:
 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
(5)碳的另一种同素异形体--石墨,其晶体结构如图所示,虚线勾勒出的是其晶胞.则石墨晶胞含碳原子个数为4个.已知石墨的密度为ρg.cm-3,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为$\frac{\sqrt{3}}{16}$ρNAr2cm.
| A. | 未成熟苹果的果肉遇碘水会变蓝 | |
| B. | 与锌块相连或与电源正极相连,钢铁一定能被保护 | |
| C. | 纤维素和油脂均可发生水解,都属于天然高分子化合物 | |
| D. | 加酶洗衣粉可以很好的洗涤毛织品上的污渍 |
| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| B. | 向次氯酸钙溶液通入SO2:Ca2++2C1O-+H2O+SO2═CaSO3↓+2HC1O | |
| C. | 氢氧化钙溶液气碳酸氢镁溶液反应:Ca2++OH-+HCO3 -═CaCO3↓+H2O | |
| D. | 硫酸亚铁的酸性溶液中加入H2O2溶液:Fe 2++H2O2+2H+═Fe 3++2H2O |
| A. | C的体积分数增大 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
| A. | 乙烷通入溴水中 | B. | 乙烯与溴化氢反应 | ||
| C. | 乙烯通入溴水中 | D. | 乙烷与溴蒸气在光照下反应 |
| A. | 0.1molNa2O2中含有的离子数为0.4NA | |
| B. | 利用氧化还原反应原理制取1mol氧气,转移的电子数一定为4NA | |
| C. | 7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA | |
| D. | 0.1mol氯气与金属铁完全反应时,转移电子数为0.2NA |
 铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
 .
. .
. .
.