题目内容
10.若NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 0.1molNa2O2中含有的离子数为0.4NA | |
| B. | 利用氧化还原反应原理制取1mol氧气,转移的电子数一定为4NA | |
| C. | 7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA | |
| D. | 0.1mol氯气与金属铁完全反应时,转移电子数为0.2NA |
分析 A、过氧化钠由2个钠离子和1个过氧根构成;
B、利用氧化还原反应原理制取1mol氧气,氧元素在被氧化之前的价态不明确;
C、求出氯气的物质的量,然后根据氯气和碱的反应为歧化反应来分析;
D、氯气和铁反应后变为-1价.
解答 解:A、过氧化钠由2个钠离子和1个过氧根构成,故0.1mol过氧化钠中含0.3mol即0.3NA个离子,故A错误;
B、利用氧化还原反应原理制取1mol氧气,氧元素在被氧化之前的价态不明确,可能是-2价,也可能是-1价,故转移的电子数不一定为4NA个,故B错误;
C、7.1g氯气的物质的量为0.1mol,而氯气和碱的反应为歧化反应,故0.1mol氯气转移0.1mol电子即0.1NA个,故C错误;
D、氯气和铁反应后变为-1价,故0.1mol氯气反应后转移0.2NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.某化学小组在实验室制取Na2O2.查阅资料可知:钠与空气在453~473K之间可生成Na2O,迅速提高温度到573~673K之间可生成Na2O2,若温度提高到733~873K之间Na2O2可分解.除Li外其他碱金属不与N2反应.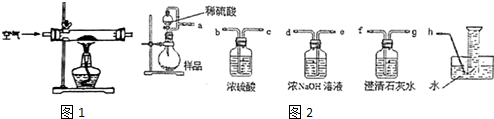
(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
在上述实验中,能够证明乙组分析正确的最佳方案是I(填实验序号).根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是碱性条件.
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].

(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液加入少量Mn02粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2〜3滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2〜3滴酚酞试液,充分振荡,然后逐 滴加入过量的NaOH稀溶液 | 开始无明显现象.加NaOH溶 液先变红后褪色 |
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].
1.乙苯催化脱氢生产苯乙烯的反应:

(1)一定温度下,将a mol乙苯加入体积为V L的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如表:
①平衡时,容器中气体物质的量总和为1.4amol,乙苯的转化率为40%.
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$.
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小.

(1)一定温度下,将a mol乙苯加入体积为V L的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$.
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小.
18.下列离子反应,表达正确的是( )
| A. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+═2Fe3++3H2O | |
| B. | CaCO3与醋酸(CH3COOH)反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 向硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | MgSO4溶液跟Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ |
15.下列离子在指定的溶液中能大量共存的一组是( )
| A. | 加入甲基橙显红色的溶液中:Mg2+、Fe2+、Cl-、NO3- | |
| B. | pH=12的无色透明溶液中:Mg2+、SO42-、NO3-、K+ | |
| C. | 无色透明溶液中:SO42-、NO3-、Na+、Fe3+ | |
| D. | 澄清透明溶液中:Cu2+、SO42-、K+、Br- |
2.下列装置用于实验室制氨气或验证氨气的某化学性质,其中能达到实验目的是( )
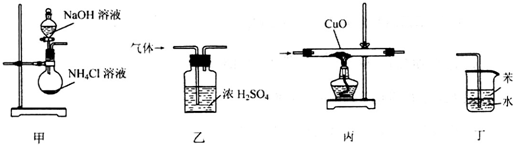

| A. | 用装置甲制取氨气 | B. | 用装置乙除去氨气中的水蒸气 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收尾气 |
 ;D在元素周期表中的位置为第三周期ⅢA族.
;D在元素周期表中的位置为第三周期ⅢA族. 用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理.
用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理.