题目内容
1.能正确表示下列反应的离子方程式是( )| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| B. | 向次氯酸钙溶液通入SO2:Ca2++2C1O-+H2O+SO2═CaSO3↓+2HC1O | |
| C. | 氢氧化钙溶液气碳酸氢镁溶液反应:Ca2++OH-+HCO3 -═CaCO3↓+H2O | |
| D. | 硫酸亚铁的酸性溶液中加入H2O2溶液:Fe 2++H2O2+2H+═Fe 3++2H2O |
分析 A.氢氧化钠少量,反应生成碳酸钙沉淀、碳酸氢钠和水;
B.次氯酸具有强氧化性,能够将亚硫酸钙氧化成硫酸钙;
C.反应生成碳酸钙沉淀和氢氧化镁沉淀;
D.硫酸亚铁被双氧水氧化成硫酸铁.
解答 解:A.Ca(HCO3)2溶液中加入少量NaOH溶液,反应生成碳酸钙沉淀、碳酸氢钠和水,正确的离子方程式为:Ca2++HCO3-+OH-═CaCO3↓+H2O,故A错误;
B.向次氯酸钙溶液通入SO2,二者发生氧化还原反应,二氧化硫少量时,正确的离子方程式为:Ca2++3ClO-+H2O+SO2═CaSO4↓+2HClO+Cl-,故B错误;
C.过量氢氧化钙溶液与碳酸氢镁溶液反应的离子反应为:2Ca2++4OH-+Mg2++2HCO3-═Mg(OH)2↓+2CaCO3↓+2H2O,故C错误;
D.硫酸亚铁的酸性溶液中加入H2O2溶液,二者发生氧化还原反应,反应的离子方程式为:Fe2++H2O2+2H+═Fe3++2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
12.下列离子方程式中,正确的是( )
| A. | Na2O2固体溶于足量水中:2O${\;}_{2}^{2-}$+2H2O═4OH-+O2↑ | |
| B. | 次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | 碳酸氢钙溶液中滴入少量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 硝酸铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
16.某化学小组在实验室制取Na2O2.查阅资料可知:钠与空气在453~473K之间可生成Na2O,迅速提高温度到573~673K之间可生成Na2O2,若温度提高到733~873K之间Na2O2可分解.除Li外其他碱金属不与N2反应.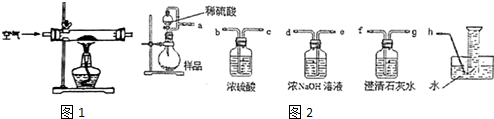
(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
在上述实验中,能够证明乙组分析正确的最佳方案是I(填实验序号).根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是碱性条件.
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].

(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液加入少量Mn02粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2〜3滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2〜3滴酚酞试液,充分振荡,然后逐 滴加入过量的NaOH稀溶液 | 开始无明显现象.加NaOH溶 液先变红后褪色 |
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].
6.一定温度下,在体积为10L的密闭容器中,3molX和1molY进行应:2X(g)+Y(g)?Z(g),经2min达到平衡,生成0.6mol Z,下列说法正确的是( )
| A. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度为原来的1/2 | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H<0 |
10.下列说法不正确的是( )
| A. | C2H6和C9H20一定互为同系物 | |
| B. | 丙氨酸和苯丙氨酸脱水缩合,最多可生成3中二肽 | |
| C. | 葡萄糖在人体内被氧化,最终转化为二氧化碳和水,并释放能量 | |
| D. | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀析出,再加水沉淀会溶解 |
15.下列离子在指定的溶液中能大量共存的一组是( )
| A. | 加入甲基橙显红色的溶液中:Mg2+、Fe2+、Cl-、NO3- | |
| B. | pH=12的无色透明溶液中:Mg2+、SO42-、NO3-、K+ | |
| C. | 无色透明溶液中:SO42-、NO3-、Na+、Fe3+ | |
| D. | 澄清透明溶液中:Cu2+、SO42-、K+、Br- |
 已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O△H<0
已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O△H<0