题目内容
5.可以制取较为纯净的溴乙烷的方法是( )| A. | 乙烷通入溴水中 | B. | 乙烯与溴化氢反应 | ||
| C. | 乙烯通入溴水中 | D. | 乙烷与溴蒸气在光照下反应 |
分析 制取较为纯净的溴乙烷,利用乙烯与HBr发生加成反应,产物只有一种,以此来解答.
解答 解:A.乙烷通入溴水中,不反应,故A不选;
B.乙烯与溴化氢反应生成溴乙烷,故B选;
C.乙烯通入溴水中,发生加成反应生成1,2-二溴乙烷,故C不选;
D.乙烷与溴蒸气在光照下反应,为取代反应,产物复杂,故D不选;
故选B.
点评 本题考查有机物的结构与性质及制备,为高频考点,把握烯烃的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
15.图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下0.46 mol气体 | |
| C. | 配制200 mL 4.6mol•L-1的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
16.某化学小组在实验室制取Na2O2.查阅资料可知:钠与空气在453~473K之间可生成Na2O,迅速提高温度到573~673K之间可生成Na2O2,若温度提高到733~873K之间Na2O2可分解.除Li外其他碱金属不与N2反应.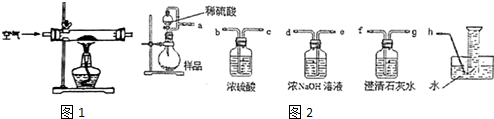
(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
在上述实验中,能够证明乙组分析正确的最佳方案是I(填实验序号).根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是碱性条件.
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].

(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液加入少量Mn02粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2〜3滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2〜3滴酚酞试液,充分振荡,然后逐 滴加入过量的NaOH稀溶液 | 开始无明显现象.加NaOH溶 液先变红后褪色 |
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].
10.下列说法不正确的是( )
| A. | C2H6和C9H20一定互为同系物 | |
| B. | 丙氨酸和苯丙氨酸脱水缩合,最多可生成3中二肽 | |
| C. | 葡萄糖在人体内被氧化,最终转化为二氧化碳和水,并释放能量 | |
| D. | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀析出,再加水沉淀会溶解 |
1.乙苯催化脱氢生产苯乙烯的反应:

(1)一定温度下,将a mol乙苯加入体积为V L的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如表:
①平衡时,容器中气体物质的量总和为1.4amol,乙苯的转化率为40%.
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$.
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小.

(1)一定温度下,将a mol乙苯加入体积为V L的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$.
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小.
18.下列离子反应,表达正确的是( )
| A. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+═2Fe3++3H2O | |
| B. | CaCO3与醋酸(CH3COOH)反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 向硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | MgSO4溶液跟Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ |
 已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O△H<0
已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O△H<0
 +H2O→RCOOH+R′COOH
+H2O→RCOOH+R′COOH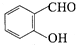 中的官能团名称为醛基、羟基
中的官能团名称为醛基、羟基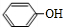 ,DCH3COOH,G
,DCH3COOH,G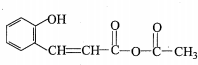

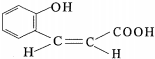
 氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式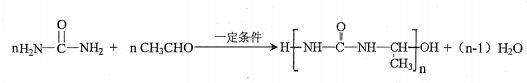
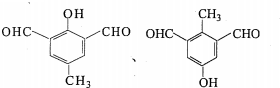 .
.