题目内容
6. 铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3.
请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为0>N>C,基态Fe原子的价电子排布式为3d64s2.
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是分子晶体,Fe(CO)5在空气中燃烧后剩余的固体呈红棕色,相应的化学方程式为4Fe(CO)5+13O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+20CO2.
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是sp3、sp2,配体中提供孤对电子的原子是N.
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有bd形成;
a.离子键 b.配位键 c.非极性键 d.δ键
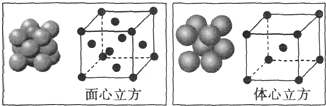
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为2:1,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为4$\sqrt{2}$:3$\sqrt{3}$(写出已化简的比例式即可).
分析 (1)同一周期元素,元素电负性能随着原子序数增大而增大;Fe原子3d、4s能级电子为其价电子;
(2)熔沸点较低的晶体为分子晶体;Fe(CO)5在空气中燃烧后剩余的固体呈红棕色,为氧化铁,同时生成C的稳定氧化物二氧化碳;
(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式;该配体中Cu原子提供空轨道、N原子提供孤电子对;
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有配位键和δ键生成;
(5)利用均摊法计算晶胞中Fe原子个数;根据密度公式ρ=$\frac{\frac{M}{{N}_{A}}×Fe原子个数}{V}$.
解答 解:(1)同一周期元素,元素电负性随着原子序数增大而增大,这三种元素第一电离能大小顺序是0>N>C;Fe原子3d、4s能级电子为其价电子,基态Fe原子的价电子排布式为3d64s2,
故答案为:0>N>C;3d64s2;
(2)熔沸点较低的晶体为分子晶体,Fe(CO)5又名羰基铁,常温下为黄色油状液体,其熔沸点较低,为分子晶体;Fe(CO)5在空气中燃烧后剩余的固体呈红棕色,为氧化铁,同时生成C的稳定氧化物二氧化碳,
反应方程式为4Fe(CO)5+13O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+20CO2,
故答案为:分子晶体;4Fe(CO)5+13O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+20CO2;
(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式为sp3、sp2,该配体中Cu原子提供空轨道、N原子提供孤电子对,
故答案为:sp3、sp2;N;
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有Cu原子和N、C原子之间的配位键且也是δ键生成,
故选bd;
(5)利用均摊法计算晶胞中Fe原子个数,面心立方晶胞中Fe原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、体心立方晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,所以二者Fe原子个数之比=4:2=2:1;
设Fe原子半径为rcm,面心立方晶胞半径=2$\sqrt{2}$rcm,其体积=(2$\sqrt{2}$rcm)3,
体心立方晶胞半径=$\frac{4\sqrt{3}}{3}$rcm,体积=($\frac{4\sqrt{3}}{3}$rcm)3,
其密度之比=$\frac{\frac{M}{{N}_{A}}×4}{(2\sqrt{2}rcm)^{3}}$:$\frac{\frac{M}{{N}_{A}}×2}{(\frac{4\sqrt{3}}{3}rcm)^{3}}$=4$\sqrt{2}$:3$\sqrt{3}$,
故答案为:2:1;4$\sqrt{2}$:3$\sqrt{3}$.
点评 本题考查晶胞计算,为高频考点,侧重考查学生分析计算及空间想象能力,涉及晶胞计算、原子杂化方式判断、元素周期律等知识点,难点是晶胞计算,注意Fe晶胞面心立方和体心立方区别,关键会正确计算两种晶胞体积,题目难度中等.

| A. | N2 | B. | NH4Cl | C. | H2O | D. | H2SO4 |
| A. | 分子式分别为C2H6和C4H10的两种有机化合物一定互为同系物 | |
| B. | 某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变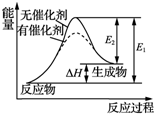 | |
| C. | 非金属氧化物一定是酸性氧化物 | |
| D. | 1 mol N2与3 mol H2在一定条件下充分反应可得2 mol NH3 |
①将地沟油回收加工为生物柴油,提高资源的利用率
②进口国外电子垃圾,回收其中的贵重金属
③燃煤进行脱硫脱硝处理,减少硫的氧化物和氮的氧化物的排放
④洗衣粉中添加三聚磷酸钠(Na3P5O10),增强去污效果
⑤易降解的生物农药更适合于在未来有害生物综合治理中的应用.
| A. | ①③⑤ | B. | ②⑤ | C. | ③④ | D. | ①②③④⑤ |
①石油分馏得到汽油 ②煤通过干馏获得焦炭 ③用铝土矿冶炼铝 ④用海带提取碘单质 ⑤空气液化 ⑥白酒变酸 ⑦粉尘爆炸 ⑧干冰气化 ⑨同素异形体之间的互变 ⑩氯化钠溶液通电后导电⑪活性炭使红墨水褪色⑫新制氯水使有色布条褪色.
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | HCl、HBr、HI | D. | SO2、CO2、O2 |

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下0.46 mol气体 | |
| C. | 配制200 mL 4.6mol•L-1的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
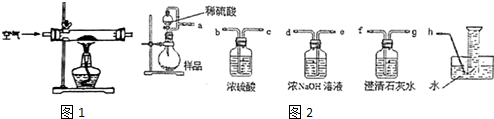
(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液加入少量Mn02粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2〜3滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2〜3滴酚酞试液,充分振荡,然后逐 滴加入过量的NaOH稀溶液 | 开始无明显现象.加NaOH溶 液先变红后褪色 |
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].