题目内容
11.化学与生产、生活密切相关.下列说法正确的是( )| A. | 未成熟苹果的果肉遇碘水会变蓝 | |
| B. | 与锌块相连或与电源正极相连,钢铁一定能被保护 | |
| C. | 纤维素和油脂均可发生水解,都属于天然高分子化合物 | |
| D. | 加酶洗衣粉可以很好的洗涤毛织品上的污渍 |
分析 A.碘遇到淀粉变蓝;
B、电解池的阴极金属一定被保护,阳极金属易被腐蚀,原电池的负极金属被腐蚀;
C、高分子化合物(又称高聚物)一般相对分子质量高于10000,结构中有重复的结构单元;有机高分子化合物可以分为天然有机高分子化合物(如淀粉、纤维素、蛋白质天然橡胶等)和合成有机高分子化合物(如聚乙烯、聚氯乙烯等);
D、毛织品的成分是蛋白质.
解答 解:A.未成熟的苹果含有大量的淀粉,碘遇到淀粉变蓝,故A正确;
B、与锌块相连,钢铁被保护,或与电源正极相连,钢铁被腐蚀,故B错误;
C、油脂相对分子质量较小,不是高分子化合物,纤维素为多糖,相对分子质量在一万以上,为天然高分子化合物,故C错误;
D.毛织品的成分是蛋白质,加酶洗衣粉能使蛋白质发生水解,衣服损坏,故D错误.
故选A.
点评 本题考查了淀粉、纤维素的性质以及电化学原理的应用知识,题目难度不大,注意高分子化合物的特点是关键.

练习册系列答案
 能力评价系列答案
能力评价系列答案
相关题目
1.下列过程属于物理变化的有( )
①石油分馏得到汽油 ②煤通过干馏获得焦炭 ③用铝土矿冶炼铝 ④用海带提取碘单质 ⑤空气液化 ⑥白酒变酸 ⑦粉尘爆炸 ⑧干冰气化 ⑨同素异形体之间的互变 ⑩氯化钠溶液通电后导电⑪活性炭使红墨水褪色⑫新制氯水使有色布条褪色.
①石油分馏得到汽油 ②煤通过干馏获得焦炭 ③用铝土矿冶炼铝 ④用海带提取碘单质 ⑤空气液化 ⑥白酒变酸 ⑦粉尘爆炸 ⑧干冰气化 ⑨同素异形体之间的互变 ⑩氯化钠溶液通电后导电⑪活性炭使红墨水褪色⑫新制氯水使有色布条褪色.
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
2.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | F-离子结构示意图 | ||
| C. | 次氯酸电子式  | D. | 用电子式表示HCl形成过程  |
19.古代的很多成语、谚语都蕴含着很多科学知识,下列对成语、谚语的解释正确的是( )
| A. | “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高 | |
| B. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| C. | “甘之如饴”说明糖类均有甜味 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
6.铅蓄电池在现代生活中有广泛应用,其电极材料是Pb和PbO2,电解液是硫酸溶液.现用铅蓄电池电解硫酸钠溶液一段时间后,假设电解时温度不变且惰性电极,下列说法正确的是( )
| A. | 蓄电池放电时,每消耗0.1molPb,共生成0.1mol PbSO4 | |
| B. | 电解硫酸钠溶液时的阳极反应式为:4OH--4e-=2H2O+O2↑ | |
| C. | 电解后,硫酸钠溶液中有晶体析出,但c(Na2SO4)会变小 | |
| D. | 蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变大 |
16.某化学小组在实验室制取Na2O2.查阅资料可知:钠与空气在453~473K之间可生成Na2O,迅速提高温度到573~673K之间可生成Na2O2,若温度提高到733~873K之间Na2O2可分解.除Li外其他碱金属不与N2反应.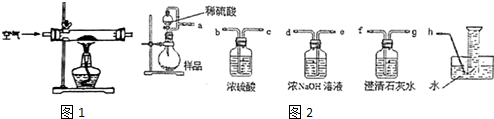
(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
在上述实验中,能够证明乙组分析正确的最佳方案是I(填实验序号).根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是碱性条件.
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].

(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液加入少量Mn02粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2〜3滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2〜3滴酚酞试液,充分振荡,然后逐 滴加入过量的NaOH稀溶液 | 开始无明显现象.加NaOH溶 液先变红后褪色 |
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].
3.一定条件下,在水溶液中1molCl-,ClOx(x=1,2,3,4)的能量(kJ)相对大小如图所示.下列有关说法正确的是( )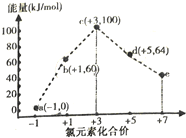

| A. | e是ClO3- | |
| B. | b→a+c反应的活化能为60kJ•mol-1 | |
| C. | a,b,c,d,e中c最稳定 | |
| D. | b→a+d反应的热化学方程式为3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-116kJ•mol-1 |

 +H2O→RCOOH+R′COOH
+H2O→RCOOH+R′COOH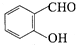 中的官能团名称为醛基、羟基
中的官能团名称为醛基、羟基 ,DCH3COOH,G
,DCH3COOH,G


 氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式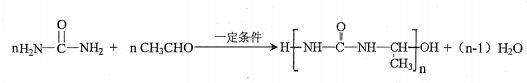
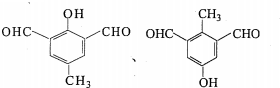 .
. ;D在元素周期表中的位置为第三周期ⅢA族.
;D在元素周期表中的位置为第三周期ⅢA族.