题目内容
8.在密闭容器中,一定量混合气体发生下列反应:aA(g)+bB(g)?cC(g)+dD(g),达到平衡后,测得C气体的浓度为0.5mol/L.恒温下,将密闭容器的体积缩小为$\frac{1}{2}$,再达平衡时,测得C气体的浓度为0.9mol/L.则下列叙述正确的是( )| A. | C的体积分数增大 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
分析 保持温度不变,将容器的体积缩小1倍,如果平衡不移动,C气体的浓度为1mol/L,实际C的浓度变为0.9mol/L,说明平衡向逆反应方向移动,据此结合选项解答.
解答 解:保持温度不变,将容器的体积缩小1倍,如平衡不移动,C气体的浓度为1mol/L,实际C的浓度变为0.9mol/L,说明平衡向逆反应方向移动,
A.C的物质的量浓度减小了,所以其体积分数减小,故A错误;
B、保持温度不变,将容器的体积缩小1倍,如平衡不移动,C气体的浓度为1mol/L,实际C的浓度变为0.9mol/L,说明平衡向逆反应方向移动,故B错误;
C.平衡逆向移动,反应物转化率降低,故C错误;
D.保持温度不变,将容器的体积缩小1倍,平衡向逆反应方向移动,说明反应物气体物质的量比生成物小,a+b<c+d,故D正确;
故选D.
点评 本题考查了化学平衡的影响因素,题目难度中等,明确化学平衡及其影响因素为解答关键,注意“将密闭容器的体积缩小为$\frac{1}{2}$,再达平衡时,测得C气体的浓度为0.9mol/L”实际上C的浓度减小了,为易错点,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是( )
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | HCl、HBr、HI | D. | SO2、CO2、O2 |
19.古代的很多成语、谚语都蕴含着很多科学知识,下列对成语、谚语的解释正确的是( )
| A. | “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高 | |
| B. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| C. | “甘之如饴”说明糖类均有甜味 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
16.某化学小组在实验室制取Na2O2.查阅资料可知:钠与空气在453~473K之间可生成Na2O,迅速提高温度到573~673K之间可生成Na2O2,若温度提高到733~873K之间Na2O2可分解.除Li外其他碱金属不与N2反应.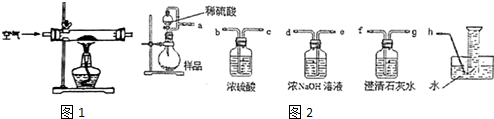
(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
在上述实验中,能够证明乙组分析正确的最佳方案是I(填实验序号).根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是碱性条件.
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].

(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液加入少量Mn02粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2〜3滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2〜3滴酚酞试液,充分振荡,然后逐 滴加入过量的NaOH稀溶液 | 开始无明显现象.加NaOH溶 液先变红后褪色 |
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].
3.一定条件下,在水溶液中1molCl-,ClOx(x=1,2,3,4)的能量(kJ)相对大小如图所示.下列有关说法正确的是( )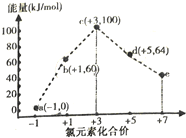

| A. | e是ClO3- | |
| B. | b→a+c反应的活化能为60kJ•mol-1 | |
| C. | a,b,c,d,e中c最稳定 | |
| D. | b→a+d反应的热化学方程式为3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-116kJ•mol-1 |
1.乙苯催化脱氢生产苯乙烯的反应:

(1)一定温度下,将a mol乙苯加入体积为V L的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如表:
①平衡时,容器中气体物质的量总和为1.4amol,乙苯的转化率为40%.
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$.
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小.

(1)一定温度下,将a mol乙苯加入体积为V L的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$.
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小.
2.下列装置用于实验室制氨气或验证氨气的某化学性质,其中能达到实验目的是( )
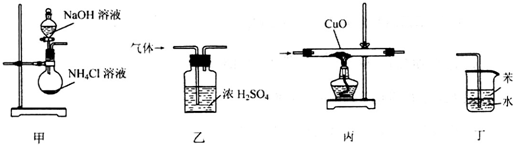

| A. | 用装置甲制取氨气 | B. | 用装置乙除去氨气中的水蒸气 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收尾气 |
 已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O△H<0
已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O△H<0
 +H2O→RCOOH+R′COOH
+H2O→RCOOH+R′COOH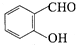 中的官能团名称为醛基、羟基
中的官能团名称为醛基、羟基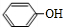 ,DCH3COOH,G
,DCH3COOH,G


 氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式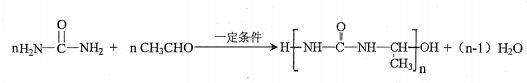
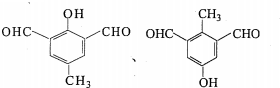 .
.