题目内容
7.下表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题.
(1)元素④的名称是氧,元素④在周期表中所处位置第二周期第ⅥA族,从元素原子得失电子的角度看,元素④形成的单质具有氧化性(填“氧化性”或“还原性”).
(2)元素⑦的原子结构示意图是
 .
.(3)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:PH3<H2S<H2O(写氢化物的化学式).
(4)写出元素⑤形成的单质与水反应的化学方程式,并标出电子转移的方向和数目
 .
.(5)①与⑦能形成一种化合物,用电子式表示该化合物的形成过程
 .
.
分析 由①~⑨九种元素在周期表中的位置可知,①~⑨分别为H、C、N、O、Na、P、S、Ne、Cl,
(1)④为O,位于第二周期第ⅥA族,易得到电子;
(2)S原子结构中含3个电子层,最外层电子数为6;
(3)非金属性越强,气态氢化物越稳定;
(4)Na与水反应生成NaOH和氢气,该反应转移2e-;
(5)①与⑦能形成一种化合物为硫化氢,为共价化合物.
解答 解:由①~⑨九种元素在周期表中的位置可知,①~⑨分别为H、C、N、O、Na、P、S、Ne、Cl,
(1)④为O,名称为氧,位于第二周期第ⅥA族,易得到电子,则元素④形成的单质具有氧化性,故答案为:氧;第二周期第ⅥA族;氧化;
(2)S原子结构中含3个电子层,最外层电子数为6,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)非金属性O>S>P,⑥④⑦的氢化物稳定性为PH3<H2S<H2O,故答案为:PH3<H2S<H2O;
(4)Na与水反应生成NaOH和氢气,该反应转移2e-,标出电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
(5)①与⑦能形成一种化合物为硫化氢,为共价化合物,用电子式表示该化合物的形成过程为 ,
,
故答案为: .
.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列说法正确的是( )
| A. | 分子式分别为C2H6和C4H10的两种有机化合物一定互为同系物 | |
| B. | 某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变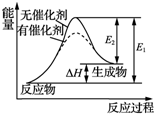 | |
| C. | 非金属氧化物一定是酸性氧化物 | |
| D. | 1 mol N2与3 mol H2在一定条件下充分反应可得2 mol NH3 |
18.下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是( )
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | HCl、HBr、HI | D. | SO2、CO2、O2 |
15.图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下0.46 mol气体 | |
| C. | 配制200 mL 4.6mol•L-1的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
2.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | F-离子结构示意图 | ||
| C. | 次氯酸电子式  | D. | 用电子式表示HCl形成过程  |
12.下列离子方程式中,正确的是( )
| A. | Na2O2固体溶于足量水中:2O${\;}_{2}^{2-}$+2H2O═4OH-+O2↑ | |
| B. | 次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | 碳酸氢钙溶液中滴入少量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 硝酸铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
19.古代的很多成语、谚语都蕴含着很多科学知识,下列对成语、谚语的解释正确的是( )
| A. | “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高 | |
| B. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| C. | “甘之如饴”说明糖类均有甜味 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
16.某化学小组在实验室制取Na2O2.查阅资料可知:钠与空气在453~473K之间可生成Na2O,迅速提高温度到573~673K之间可生成Na2O2,若温度提高到733~873K之间Na2O2可分解.除Li外其他碱金属不与N2反应.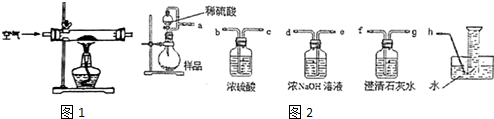
(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
在上述实验中,能够证明乙组分析正确的最佳方案是I(填实验序号).根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是碱性条件.
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].

(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为bcd.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果偏大(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是aedfgh.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果偏小(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液加入少量Mn02粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2〜3滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2〜3滴酚酞试液,充分振荡,然后逐 滴加入过量的NaOH稀溶液 | 开始无明显现象.加NaOH溶 液先变红后褪色 |
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算].
1.乙苯催化脱氢生产苯乙烯的反应:

(1)一定温度下,将a mol乙苯加入体积为V L的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如表:
①平衡时,容器中气体物质的量总和为1.4amol,乙苯的转化率为40%.
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$.
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小.

(1)一定温度下,将a mol乙苯加入体积为V L的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$.
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小.