题目内容
11.所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色.
(1)写出该实验中生成乙烯的化学方程式:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是BC(填字母序号)
A.乙烯与溴水易发生取代反应B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯D.浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
(3)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是液体分两层,下层有油状液体
(4)丙同学对上述实验装置进行了改进,在I和II之间增加如图2装置,则A中的试剂应为NaOH溶液,其作用是吸收二氧化硫,B中的试剂为品红溶液
(5)处理上述实验后烧瓶中废液的正确方法是B(填字母序号)
A.废液冷却后倒入下水道中B.废液冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸.
分析 (1)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯;
(2)浓硫酸具有强氧化性,能将乙醇氧化生成碳,自身被还原生成二氧化硫,二氧化硫含有还原性;
(3)乙烯和溴发生加成反应生成溴代烃,溴代烃不溶于水且密度大于水;
(4)二氧化硫属于酸性氧化物,能将二氧化硫吸收,二氧化硫能使品红溶液褪色;
(5)废液温度较高,应该冷却后再处理,烧瓶中含有浓硫酸,具有腐蚀性,所以要集中处理.
解答 解:(1)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯,反应方程式为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑,
故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑;
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,自身被还原生成二氧化硫,C+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,SO2具有还原性,可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,
故选:BC;
(3)溴水中的溴与反应生成的乙烯发生加成反应,方程式为:CH2=CH2+Br2→CH2BrCH2Br,1,2-二溴乙烷密度大于水在试管底层为油状物质;
故答案为:液体分两层,下层有油状液体;
(4)二氧化硫能和溴发生氧化还原反应而使溴水褪色,从而干扰乙烯的检验,二氧化硫属于酸性氧化物,能和碱反应生成盐,为防止二氧化硫干扰乙烯的检验,可以用氢氧化钠溶液除去二氧化硫,二氧化硫能使品红溶液褪色,所以可以用品红溶液检验二氧化硫,实验时要先吸收二氧化硫,再检验二氧化硫是否被除尽,则A中的试剂是NaOH溶液,B中液体是品红溶液,
故答案为:NaOH溶液;吸收SO2;品红溶液;
(5)实验后的烧瓶温度较高,为防止炸裂烧瓶,不能向烧瓶中加入水,要自燃冷却烧瓶至室温,烧瓶中含有浓硫酸,具有强腐蚀性,不能随便倾倒,要倒入废液缸中集中处理,
故选B.
点评 本题考查了实验室制取乙烯实验,明确实验原理是解本题关键,根据浓硫酸、乙烯的性质来分析解答,注意二氧化硫、乙烯都能使溴水褪色,但褪色原理不同,乙烯使溴水褪色是发生了加成反应,二氧化硫使溴水褪色是发生了氧化还原反应,题目难度中等.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
(1)实验的记时方法是从溶液混合开始记时,至紫红色刚好褪去时,记时结束.
(2)实验①和②研究浓度对反应速率的影响,则V1=5.0mL,V2=3.0mL.
(3)下列有关该实验的叙述正确的是C、D.
A.实验时必须用移液管或滴定管来量取液体的体积
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数.
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(4)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是反应生成的Mn2+对反应有催化作用.
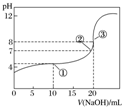
| A. | 该中和滴定过程,最宜用石蕊作指示剂 | |
| B. | 图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 | |
| C. | 滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 | |
| D. | 图中点②所示溶液中,c(CH3COO-)=c(Na+) |
| A. | 若浓硫酸不慎洒落在皮肤上应立即用干布拭去,再用大量水冲洗 | |
| B. | 可使蔗糖变黑,体现了浓硫酸的吸水性 | |
| C. | 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 | |
| D. | 可使胆矾变白,体现了浓硫酸的脱水性 |
| A. | 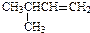 2-甲基-3-丁烯 2-甲基-3-丁烯 | B. | 乙炔的结构简式:CHCH | ||
| C. | 乙醚的分子式:C 2H 6O | D. | 甲基的电子式: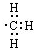 |
| 步骤 | 操作 | 现象 |
| (1) | 取少量溶液滴加几滴石蕊试液 | 溶液变蓝 |
| (2) | 另取少量溶液滴加过量氯水,再加入CCl4振荡,静置 | 上层无色,下层呈紫色 |
| (3) | 取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3,过滤 | 有白色沉淀产生 |
| (4) | 向(3)的滤液中加入过量AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 可能含有 Cl-、SO32-、SO42- | B. | 肯定没有 Ba2 +、Cl-、I- | ||
| C. | 不能确定 Na+、SO32-、SO42- | D. | 肯定含有 Na+、I-、SO32- |
| A. | 单质分子中一定不存在共价键 | |
| B. | 气态物质中一定有共价键 | |
| C. | 在共价化合物中一定有共价键 | |
| D. | 由非金属元素组成的化合物中,一定不含离子键 |
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 689 | 533 | 409 |
| A. | 反应I2 (aq)+I-(aq)?I3-(aq)的△H>0 | |
| B. | 其他条件不变,升高温度,溶液中c(I3-)减小 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时向溶液中加入少量KI固体,平衡常数K大于689 |
 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题