题目内容
1.I2在KI溶液中存在下列平衡:I2 (aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如下表:( )| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 689 | 533 | 409 |
| A. | 反应I2 (aq)+I-(aq)?I3-(aq)的△H>0 | |
| B. | 其他条件不变,升高温度,溶液中c(I3-)减小 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时向溶液中加入少量KI固体,平衡常数K大于689 |
分析 A.由表中数据可知,温度越大平衡常数越小,说明升高温度平衡向逆反应方向移动,据此判断;
B.升高温度平衡向着吸热的反应方向一定,结合A判断c(I3-)的变化;
C.加入苯,碘能溶于苯,这样水中碘的浓度变小,平衡向逆左移动;
D.平衡常数只受温度影响,与物质的浓度无关.
解答 解:A.由表中数据可知,温度越大平衡常数越小,说明升高温度平衡向逆反应方向移动,故正反应方向为放热反应,即△H<0,故A错误;
B.该反应为放热反应,升高温度后平衡向着逆向移动,则溶液中c(I3-)减小,故B正确;
C.加入苯,碘能溶于苯,这样水中碘的浓度变小,平衡向逆左移动,故C错误;
D.加入KI固体,平衡向右移动,但平衡常数只受温度影响,与物质的浓度无关,加入少量KI固体,平衡常数K不变,故D错误;
故选B.
点评 本题考查温度对化学平衡的影响、化学平衡常数及影响元素,题目难度中等,明确难溶物溶解平衡及其影响为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
12.下列电离方程式正确的是( )
| A. | NH4Cl=NH4++Cl- | B. | NaHSO4=Na++HSO42- | ||
| C. | H2CO3=2H++CO32- | D. | CH3COOH→CH3++COOH- |
9.向铁和氧化铁的混合物中加入足量的稀H2SO4,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为4:1时,被氧化的铁与被还原的铁的物质的量之比是( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 1:3 |
16.乌洛托品在合成、医药、染料等工业中有广泛用途,其结构如图.下列说法正确的是( )


| A. | 分子式为N4C6 | B. | 分子中的氮原子全部是sp2杂化 | ||
| C. | 分子中共形成4个六元环 | D. | 分子间存在氢键 |
13.常温常压下,取等物质的量的下列四种烃,分别在足量的氧气中燃烧,消耗氧气的量最多的是( )
| A. | CH4 | B. | C2H4 | C. | C2H2 | D. | C6H6 |
10.某化学兴趣小组欲研究稀H2SO4、NaCl、KCl、Na2CO3、FeCl3、NaOH的性质,对于如何研究,他们设计了两种实验方案:
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行实验.
下列说法正确的是( )
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行实验.
下列说法正确的是( )
| A. | 常温时,将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的只有稀硫酸溶液 | |
| B. | 设计方案②的同学取某种溶液,在其中加入上述的钾盐溶液,有白色沉淀产生,再加入稀硝酸,沉淀不消失,则该溶液中可能含有Ag+ | |
| C. | 按照方案①的分类,属于碱的有Na2CO3、NaOH | |
| D. | 该化学兴趣小组同学在研究物质性质时只使用了实验法、观察法 |
11.从平时学生实验中我们发现,同学们在进行实验时出现许多不正确的操作方式,希望同学们在今后的实验中,应该克服不规范的操作.请找出下列图示中正确的实验操作( )
| A. | 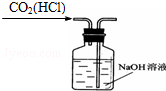 除去CO2中的HCl | B. | 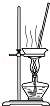 蒸发氯化钠溶液 | ||
| C. | 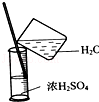 稀释浓硫酸 | D. | 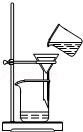 过滤 |
