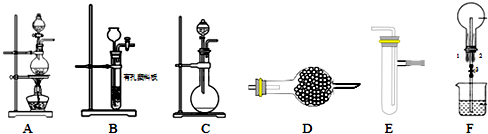
题目内容
20. 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题(1)仪器A的名称是分液漏斗;
(2)如何检验该装置的气密性利用酒精灯加热烧瓶,装置内压强增大最后装置E中导气管冒气泡,停止加热导气管中上升一段水柱,说明气密性完好;
(3)装置B中反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)装置C中所加试剂是饱和食盐水,该装置的作用是除去HCl;
(5)装置D中盛放的试剂是A(选填下列所给试剂的代码),实验现象为产生淡黄色沉淀;
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(6)装置E中盛放的试剂是氢氧化钠溶液,该装置的作用吸收多余氯气防止污染环境;
(7)若将装置B产生的气体通入少量KI溶液中,充分反应后,加入CCl4用力振荡,静置后可观察到
的现象是分层,下层四氯化碳中呈紫红色.
分析 可利用Cl2+S2-═2Cl-+S↓验证氯元素的非金属性比硫元素的非金属性强,实验时,A中发生反应为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2+2H2O,生成的氯气经除杂后,与硫化钠发生氧化还原反应,最后用氢氧化钠溶液进行尾气的吸收,以此解答该题,
(1)仪器A为分液漏斗,用于把浓盐酸添加到烧瓶中加热反应生成氯气;
(2)利用酒精灯加热烧瓶,装置内压强增大最后装置E中导气管冒气泡,停止加热导气管中上升一段水柱,说明气密性完好;
(3)装置B中是浓盐酸和二氧化锰加热反应生成氯化锰、氯气和水;
(4)装置C是吸收生成的氯气中的氯化氢气体,用饱和食盐水;
(5)要在C中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液;
(6)装置E中是氢氧化钠溶液,用来吸收多余的氯气,防止污染空气;
(7)若将装置B产生的气体通入少量KI溶液中,充分反应后,氯气氧化碘离子为碘单质,加入CCl4用力振荡,碘单质易溶于四氯化碳中;
解答 解:(1)仪器A为分液漏斗,用于把浓盐酸添加到烧瓶中加热反应生成氯气,
故答案为:分液漏斗;
(2)改变装置内的压强,观察导气管中气泡冒出和水柱上升来判断气密性,具体步骤为:利用酒精灯加热烧瓶装置内压强增大最后装置E中导气管冒气泡,停止加热导气管中上升一段水柱,说明气密性完好,
故答案为:利用酒精灯加热烧瓶,装置内压强增大最后装置E中导气管冒气泡,停止加热导气管中上升一段水柱,说明气密性完好;
(3)装置B中是浓盐酸和二氧化锰加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)由于浓盐酸易挥发,所以制备的Cl2中混有HCl,故饱和食盐水是用来吸收HCl,
故答案为:饱和食盐水;除去HCl;
(5)要在C中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,离子方程式为:Cl2+S2-═2Cl-+S↓;反应中有淡黄色沉淀生产;
故答案为:A;产生淡黄色沉淀;
(6)装置E中是氢氧化钠溶液,该装置作用是用来吸收多余的氯气,防止污染空气,
故答案为:氢氧化钠溶液,吸收多余氯气防止污染环境;
(7)若将装置B产生的气体通入少量KI溶液中,充分反应后,Cl2+2I-=I2+2Cl-,氯气氧化碘离子为碘单质,加入CCl4用力振荡,碘单质易溶于四氯化碳中,观察到的现象为:在下层四氯化碳中呈紫红色,
故答案为:分层,下层四氯化碳中呈紫红色;
点评 本题考查了物质性质实验设计与分析、实验基本操作、物质性质等知识点,注意生成的氯气的氧化性和气体除杂方法,题目难度中等.

 出彩同步大试卷系列答案
出彩同步大试卷系列答案| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 其他条件不变,向平衡体系中再充入0.32mol A,再达平衡时,B的转化率增大 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v (逆)>v (正) | |
| C. | 其他条件不变,起始时向容器中充入各0.64mol A和B,平衡时n(C)<0.48mol | |
| D. | 反应前2 min的平均速率v(C)=0.004 mol•(L•min)-1 |
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | a+1=d-2 |
| A. | NH4Cl=NH4++Cl- | B. | NaHSO4=Na++HSO42- | ||
| C. | H2CO3=2H++CO32- | D. | CH3COOH→CH3++COOH- |
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 1:3 |
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行实验.
下列说法正确的是( )
| A. | 常温时,将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的只有稀硫酸溶液 | |
| B. | 设计方案②的同学取某种溶液,在其中加入上述的钾盐溶液,有白色沉淀产生,再加入稀硝酸,沉淀不消失,则该溶液中可能含有Ag+ | |
| C. | 按照方案①的分类,属于碱的有Na2CO3、NaOH | |
| D. | 该化学兴趣小组同学在研究物质性质时只使用了实验法、观察法 |