6.某温度下,氯化镁饱和溶液浓度为40%,在足量的此溶液中加入4.6g无水氯化镁,最终析出结晶水合物40.6g,则该结晶水合物的化学式是( )
| A. | MgCl2•7H2O | B. | MgCl2•2H2O | C. | MgCl2•6H2O | D. | MgCl2•5H2O |
5.向100g饱和硫酸铜溶液中加入1.6g白色硫酸铜粉末,此时析出的晶体质量是( )
| A. | 2.5g | B. | 1.6g | C. | 大于2.5g | D. | 1.6~2.5g |
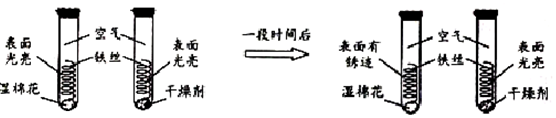
3. 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合可能是下列的( )
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合可能是下列的( )| A. | 氢氧化钙溶液、一氧化碳 | B. | 硝酸银、氯化氢 | ||
| C. | 酒精、氧气 | D. | 水、甲烷 |
2.SO2是形成酸雨的主要污染物之一,目前较为有效的处理方法是在高空喷洒一种粉末状的物质X,脱硫效果可以达到85%,化学反应方程式为2X+2SO2+O2=2CaSO4+2CO2↑,由此可知X的化学式是( )
| A. | CaO | B. | CaS | C. | CaCO3 | D. | Ca(OH)2 |
1.如图是四位同学对某一个化学方程式意义的描述,他们描述的化学方程式是( )

| A. | 2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ | B. | Na2CO3+Ca(OH)2=CaCO3↓+2NaOH | ||
| C. | C2H5OH+3O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O | D. | 2NaOH+H2SO4=Na2SO4+2H2O |
18.某同学需测定某100g过氧化氢溶液中所含过氧化氢的质量.他取10g二氧化锰放入烧杯中,并将该过氧化氢溶液全部加入,不同时间用电子天平测量其质量,所得读数如表所示:
(1)试分析,100g过氧化氢溶液完全反应后生成氧气的质量为3.2g.
(2)计算100g过氧化氢溶液中过氧化氢质量分数为多少?(写出计算过程)
0 159239 159247 159253 159257 159263 159265 159269 159275 159277 159283 159289 159293 159295 159299 159305 159307 159313 159317 159319 159323 159325 159329 159331 159333 159334 159335 159337 159338 159339 159341 159343 159347 159349 159353 159355 159359 159365 159367 159373 159377 159379 159383 159389 159395 159397 159403 159407 159409 159415 159419 159425 159433 211419
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯及所盛物质总质量/g | 335.70 | 334.30 | 334.00 | 333.50 | 333.00 | 332.50 | 332.50 |
(2)计算100g过氧化氢溶液中过氧化氢质量分数为多少?(写出计算过程)