题目内容
20.氢气和氧气点燃生成水,试计算:(1)该反应中H2、O2、H2O微粒的个数比为2:1:2
(2)该反应中H2、O2、H2O的质量比为1:8:9
(3)如果18g水生成,需要氧气16g,氢气2g
(4)只有1g氢气,最多生成水的质量9g
(5)氢气的质量为2克和氧气的质量为8克,燃烧最多能得到9g水.
分析 根据氢气和氧气在点燃的条件下生成水,依据题中的数据进行计算.
解答 解:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
(1)由化学方程式可以看出,该反应中H2、O2、H2O微粒的个数比为:2:1:2;
(2)2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
4 32 36
该反应中H2、O2、H2O的质量比为:1:8:9;
(3)设需要氧气的质量为x,氢气的质量为y
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
4 32 36
y x 18g
$\frac{4}{y}$=$\frac{32}{x}$=$\frac{36}{18g}$
x=16g
y=2g
(4)设最多生成水的质量为z
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
4 32 36
1g z
$\frac{4}{1g}$=$\frac{36}{z}$
z=9g
(5)氢气的质量为2克和氧气的质量为8克,由化学方程式可以看出,氢气过量,
设最多生成水的质量为m
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
4 32 36
8g m
$\frac{32}{8g}$=$\frac{36}{m}$
m=9g
故答案为:(1)2:1:2;
(2)1:8:9;
(3)16,2;
(4)9;
(5)9.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案| A. | 乙>丁>丙>甲 | B. | 丙>丁>乙>甲 | C. | 甲>乙>丁>丙 | D. | 丙>乙>丁>甲 |
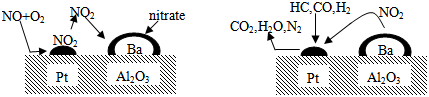
| A. | 催化剂参与反应活性研究 | B. | 金属变质机理 | ||
| C. | 汽车尾气催化转化处理 | D. | 氮气催化氧化机理 |
(1)复习酸的化学性质
| ①酸与指示剂作用 | 酸溶液能使紫色石蕊 溶液变红色 | 酸溶液不能使无色酚酞 溶液变色 |
| ②酸与活泼金属作用 | Fe+2HCl=FeCl2+H2↑ | Fe+H2SO4=FeSO4+H2↑ |
| ③酸与某些金属氧化物作用 | Fe2O3+HCl=FeCl3+H2O | … |
| ④… | ||
(2)讨论交流:小林自豪地说,食醋的酸味能促进人胃酸的分泌,胃酸的成分是HCl(填化学式).目前世界卫生组织正在推广使用中国铁锅,使用铁锅炒菜时,放点食醋时,可以补充人体需铁 元素,该反应的原理是利用了酸的化学性质②(填序号“①”、“②”或“③”).
| A. | 2.5g | B. | 1.6g | C. | 大于2.5g | D. | 1.6~2.5g |
| A. | 一定温度下,某物质的饱和溶液中加入该物质,则溶液溶质质量分数一定增大 | |
| B. | 无色透明的液体一定是溶液 | |
| C. | 升高温度,物质溶解度不一定增大 | |
| D. | 25℃时,100 g物质的饱和溶液中含A25 g,则该物质的溶解度为25 g |
| A. | 吸附剂 | B. | 凝聚剂 | C. | 消毒剂 | D. | 催化剂 |
 某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出m克合金样品,将60克稀硫酸分6次慢慢加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出m克合金样品,将60克稀硫酸分6次慢慢加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10克 | n克 |
| 第二次加入10克 | 2.0克 |
| 第三次加入10克 | 1.5克 |
| 第四次加入l0克 | 1.0克 |
| 第五次加入10克 | 0.6克 |
| 第六次加入10克 | 0.6克 |
(2)题中,m=3 n=2.5
(3)计算合金样品中镁的质量分数.
(4)计算所用稀硫酸中H2SO4的质量分数.
(5)作图,要求标出关键点的坐标.
