题目内容
15.甲、乙两化学兴趣小组用如图1所示的实验装置,通过测定产生相同体积氧气所用时间的长短来探究影响H2O2分解速率的因素.(1)甲组:按如下设计的方案实验,请完成表1:
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| Ⅰ | 探究溶液的浓度对H2O2分解速率的影响 | 25℃ | 0.2gMnO2 | 10mL 4%H2O2 |
| Ⅱ | 25℃ | 0.2gMnO2 | 10mL 8%H2O2 |
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 | 实验时溶液 酸碱度 |
| Ⅰ | 探究溶液的酸碱性 对H2O2分解速率的影响 | 25℃ | 0.2gMnO2 | 0mL 8%H2O2 | pH=10.0 |
| Ⅱ | 25℃ | 0.2gMnO2 | 0mL 8%O2 | pH=4.0 |
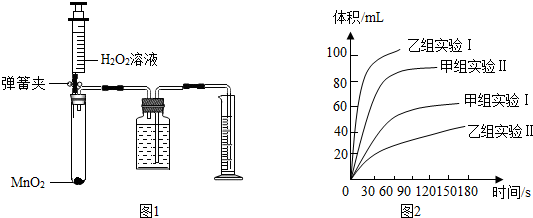
①从甲组实验得出的数据可知:H2O2浓度越大,分解速率越快.
②由乙组研究的影响H2O2分解因素的数据分析:相同条件下,H2O2在碱性(填“酸性”或“碱性”)环境下放出气体速率较快;写出H2O2分解的化学反应方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O.
【发现问题】实验开始时,H2O2溶液的温度为25℃;实验结束时,溶液的温度明显升高.说明H2O2分解是放热(选填“放热”或“吸热”)反应.
【注意:若答对第(5)小题将奖励 4分,化学卷总分不超过60分】
【反思运用】同学们经过讨论、交流和网上搜资料,提出下面两种制取H2O2液的方 法:
①用Na2O2(过氧化钠)与 H2SO4溶液作反应物,反应时将温度控制在-5~+5℃范围,生成的Na2SO4,会以
Na2SO4•10H2O晶体的形式析出,反应原理为 Na2O2+H2S04+10H2O═NaSO4•10H2O+H20,制取时Na2O2的量不能过量,因为Na2O2与水反应会生成NaOH.若Na2O2过量会造成(在碱性环境中)生成的过氧化氢分解.
②用BaO2(过氧化鋇)与H2SO4溶液作反应物.在常温下就可反应生成H2O2,试写出反应的化学方程式BaO2+H2SO4=BaSO4↓+H2O2.方法“②”比方法“①”更易操作,理由是方法①要控制好反应的温度,才能使Na2SO4•10H2O晶体析出,而方法②生成的硫酸钡是沉淀,容易与过氧化氢溶液分离.
分析 (1)对照实验要控制只能有一个变量,此变量为H2O2的浓度,则催化剂、温度应保持一致;
(2)对照实验要控制只能有一个变量,此变量为溶液的酸碱度,则其他量保持一致;
(3)①在体积-时间图,斜率即可代表化学反应速率,根据坐标得出结论;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析可知碱性越强,由图可知碱性强分解速率越快,
解答 解:(1)由甲组两个实验对比可以看出实验Ⅱ中催化剂与实验Ⅰ中的相同,而过氧化氢浓度不同,因此甲组的实验目的为探究浓度对速率的影响;故填:溶液的浓度;
(2)由乙组两个实验对比可以看出实验Ⅱ中催化剂与实验Ⅰ中的相同,过氧化氢浓度相同,但是溶液的酸碱度不同,因此乙组的实验目的为探究溶液的酸碱性对速率的影响;故填:溶液的酸碱性;
(3)①由图象可知在体积-时间图,斜率即可代表化学反应速率,由甲组实验两条曲线可知,甲组实验Ⅱ斜率大,因此H2O2的浓度越大分解速率越快;故填:越快;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析可知碱性越强,放出气体的速率越快;故填:碱性;
H2O2在MnO2催化下分解生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O;故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O;
【发现问题】反应结束后,温度有所升高,故该反应为放热反应;故填:放热;
【反思运用】①Na2O2过量会生成氢氧化钠,在碱性环境中过氧化氢会分解;故填:(在碱性环境中)生成的过氧化氢分解;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析可知碱性越强,放出气体的速率越快,由题意知Ba02固体与H2SO4溶液反应制H202的反应物为Ba02和H2SO4,产物为H202,根据原子守恒可知另一种产物为硫酸钡,即:Ba02+H2SO4=H202+BaSO4↓,由图可知酸性条件下,H202分解的速率慢.
故填:BaO2+H2SO4=BaSO4↓+H2O2;方法①要控制好反应的温度,才能使Na2SO4•10H2O晶体析出,而方法②生成的硫酸钡是沉淀,容易与过氧化氢溶液分离.
点评 本题考查了影响实验速率的因素的探究,要合理设计实验,规范进行探究,才能获得正确的信息,难度适中.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案①X+H2SO4=XSO4+H2↑②Y+H2SO4不发生反应③Y+ZSO4=YSO4+Z.
| A. | Y>X>Z | B. | X>Z>Y | C. | X>Y>Z | D. | Z>X>Y |
(1)药品的选择:实验记录如下:
| 实验序号 | 实验 | 实验现象 |
| A | 块状石灰石放入稀盐酸中 | 产生气泡速率适中 |
| B | 块状石灰石放入稀硫酸中 | 产生气泡速率缓慢,并逐渐停止 |
| C | 碳酸钠粉末放入稀盐酸中 | 产生气泡速率很快 |
(2)装置的选择:
a.如图仪器中,序号为⑤和⑩的名称为:集气瓶、水槽.
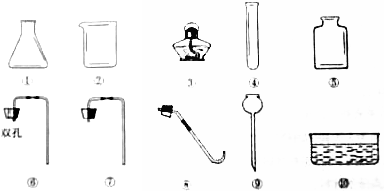
b.根据选择的药品和反应条件,组装一套实验室制取和收集二氧化碳气体的装置,应选择上图中的仪器是①⑤⑥⑨(填序号).
(3)制取和收集:图中,装入固体药品的操作正确的是C(填序号);采用向上排气法收集二氧化碳气体,利用它的密度比空气大性质.
(4)写出检验二氧化碳气体发生反应的化学方程式Ca(OH)2+CO2=CaCO3↓+H2O.
| A. | 油锅着火用水浇灭 | B. | 电器着火用泡沫灭火器灭火 | ||
| C. | 用明火检查液化气罐是否漏气 | D. | 火场逃生时用湿毛巾捂住口鼻 |
 氨气在化学工业中用途广泛,合成氨反应的微观过程如图所示:则该反应中,A与B的质量比为3:14;由该图示获得的信息还有在化学变化中分子可以再分,原子不能再分(写一条即可).
氨气在化学工业中用途广泛,合成氨反应的微观过程如图所示:则该反应中,A与B的质量比为3:14;由该图示获得的信息还有在化学变化中分子可以再分,原子不能再分(写一条即可). 金属的活动性顺序是学习化学的重要工具.
金属的活动性顺序是学习化学的重要工具.
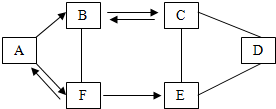 A-F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A、B、C、D、E是不同类别的物质,C俗称纯碱,E常用作建筑材料,F是人体中含量最多的物质.框图中“-”表示相连的两种物质间能发生化学反应,“→”表示物质间存在转化关系(部分反应物、生成物及反应条件已略去).请回答:
A-F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A、B、C、D、E是不同类别的物质,C俗称纯碱,E常用作建筑材料,F是人体中含量最多的物质.框图中“-”表示相连的两种物质间能发生化学反应,“→”表示物质间存在转化关系(部分反应物、生成物及反应条件已略去).请回答: