题目内容
12.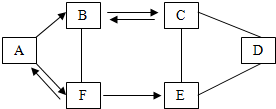 A-F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A、B、C、D、E是不同类别的物质,C俗称纯碱,E常用作建筑材料,F是人体中含量最多的物质.框图中“-”表示相连的两种物质间能发生化学反应,“→”表示物质间存在转化关系(部分反应物、生成物及反应条件已略去).请回答:
A-F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示.已知A、B、C、D、E是不同类别的物质,C俗称纯碱,E常用作建筑材料,F是人体中含量最多的物质.框图中“-”表示相连的两种物质间能发生化学反应,“→”表示物质间存在转化关系(部分反应物、生成物及反应条件已略去).请回答:(1)写出A、F的化学式:AO2,FH2O.
(2)写出B物质的一种用途灭火.
(3)B→C反应的化学方程式是CO2+2NaOH=Na2CO3+H2O,C与E反应的化学方程式是Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(4)图中物质相互间发生的反应,未涉及的基本反应类型是置换反应.
分析 根据A~F为初中化学常见的六种物质,且都含有一种相同元素,A、B、C、D、E是不同类别的物质,C俗称纯碱,所以C是碳酸钠,F是人体中含量最多的物质,所以F是水,A和水可以相互转化,所以A是氧气,氧气会转化成B,B和碳酸钠可以相互转化,所以B是二氧化碳,水会转化成E,E常用作建筑材料,E和碳酸钠会反应,所以E可以是氢氧化钙,氢氧化钙和碳酸钠都会与D反应,所以D可以是硫酸或硝酸,然后将推出的各种物质代入转化关系中验证即可
解答 解:(1)A~F为初中化学常见的六种物质,且都含有一种相同元素,A、B、C、D、E是不同类别的物质,C俗称纯碱,所以C是碳酸钠,F是人体中含量最多的物质,所以F是水,A和水可以相互转化,所以A是氧气,氧气会转化成B,B和碳酸钠可以相互转化,所以B是二氧化碳,水会转化成E,E常用作建筑材料,E和碳酸钠会反应,所以E可以是氢氧化钙,氢氧化钙和碳酸钠都会与D反应,所以D可以是硫酸或硝酸,氧气和氢气会生成水,水通电会生成氢气和氧气,氧气和木炭会生成二氧化碳,二氧化碳和水会发生反应,水和氧化钙会生成氢氧化钙,二氧化碳和碳酸钠可以相互转化,碳酸钠、氢氧化钙都会与硫酸反应,推出的A~F中都含有氧元素,推导合理,所以A是O2,F是H2O;
(2)通过推导可知B是二氧化碳,二氧化碳密度比空气大,不助燃,不可燃,所以可以用来灭火;
(3)B→C的反应是二氧化碳和氢氧化钠反应生成碳酸钠和水,化学方程式是:CO2+2NaOH=Na2CO3+H2O;
C与E的反应是氢氧化钙和碳酸钠反应生成白色的碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(4)水通电生成氧气的反应是分解反应,氧气和氢气生成水的反应是化合反应,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠的反应是复分解反应,所以图中物质相互间发生的反应,未涉及的基本反应类型是:置换反应.
故答案为:(1)O2,H2O;
(2)灭火;
(3)CO2+2NaOH=Na2CO3+H2O,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(4)置换反应.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

(1)甲组:按如下设计的方案实验,请完成表1:
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| Ⅰ | 探究溶液的浓度对H2O2分解速率的影响 | 25℃ | 0.2gMnO2 | 10mL 4%H2O2 |
| Ⅱ | 25℃ | 0.2gMnO2 | 10mL 8%H2O2 |
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 | 实验时溶液 酸碱度 |
| Ⅰ | 探究溶液的酸碱性 对H2O2分解速率的影响 | 25℃ | 0.2gMnO2 | 0mL 8%H2O2 | pH=10.0 |
| Ⅱ | 25℃ | 0.2gMnO2 | 0mL 8%O2 | pH=4.0 |
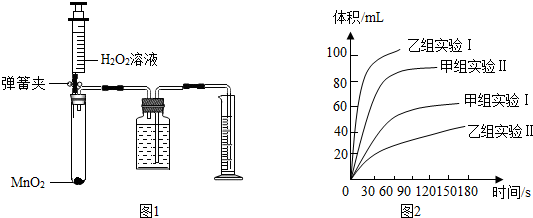
①从甲组实验得出的数据可知:H2O2浓度越大,分解速率越快.
②由乙组研究的影响H2O2分解因素的数据分析:相同条件下,H2O2在碱性(填“酸性”或“碱性”)环境下放出气体速率较快;写出H2O2分解的化学反应方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O.
【发现问题】实验开始时,H2O2溶液的温度为25℃;实验结束时,溶液的温度明显升高.说明H2O2分解是放热(选填“放热”或“吸热”)反应.
【注意:若答对第(5)小题将奖励 4分,化学卷总分不超过60分】
【反思运用】同学们经过讨论、交流和网上搜资料,提出下面两种制取H2O2液的方 法:
①用Na2O2(过氧化钠)与 H2SO4溶液作反应物,反应时将温度控制在-5~+5℃范围,生成的Na2SO4,会以
Na2SO4•10H2O晶体的形式析出,反应原理为 Na2O2+H2S04+10H2O═NaSO4•10H2O+H20,制取时Na2O2的量不能过量,因为Na2O2与水反应会生成NaOH.若Na2O2过量会造成(在碱性环境中)生成的过氧化氢分解.
②用BaO2(过氧化鋇)与H2SO4溶液作反应物.在常温下就可反应生成H2O2,试写出反应的化学方程式BaO2+H2SO4=BaSO4↓+H2O2.方法“②”比方法“①”更易操作,理由是方法①要控制好反应的温度,才能使Na2SO4•10H2O晶体析出,而方法②生成的硫酸钡是沉淀,容易与过氧化氢溶液分离.
| A. | SiO2+4HF→SiF4↑+2H2O | B. | SiO2+CaO $\stackrel{高温}{→}$ CaSiO3 | ||
| C. | SiO2+2C$\stackrel{高温}{→}$Si+2CO↑ | D. | SiO2+2NaOH→Na2SiO3+H2O |
| A. | 酒精、乙醇、C2H5OH | B. | 小苏打、纯碱、NaOH | ||
| C. | 熟石灰、氧化钙、CaO | D. | 可燃冰、甲烷、CH4 |

| A. | Z一定是氧化物 | B. | 该反应是分解反应 | ||
| C. | Y的化学式可表示为CH2 | D. | 生成Y、Z的质量比是14:9 |
(1)海水中富含钾、钙、镁等,这里的“钾、钙、镁”指的是元素(选填“元素”、“原子”).
(2)珍爱水资源,是每个公民应尽的义务.下列做法有利于保护水资源的是AD(填序号)
A、合理使用化肥农药 B.生活污水直接排放 C.使用含磷洗衣粉 D、工业废水处理达标后排放
(3)图1所示装置可以对河水进行简单净化.其中能起到吸附作用的是活性炭,可用肥皂水鉴别净化后的水是硬水还是软水,若要得到纯度更高的水,实验室中常采用的方法是蒸馏.
(4)高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂,其中铁元素的化合价是+6.
(5)用如图2装置可以证明水的组成.b管中产生的气体是氢气.该实验中,常往水里加入少量的硫酸钠以增强水的导电性,而硫酸钠的质量不变.现将0.2g的硫酸钠溶解在49.8g水中,一段时间后,硫酸钠的质量分数为0.8%,则有25g水被电解.

(6)氯化钠是一种重要的资源,在海水中储量很丰富.
①海水晒盐是海水在常温下蒸发得到氯化钠.实验室用氯化钠溶液模拟该过程如图3:已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是A(填编号),与B溶液中溶质质量分数相等的溶液是CD(填编号)
②如表是NaCl和KNO3在不同温度时的溶解度,NaCl和KNO3在t℃时的溶解度均为Wg,分析如表可推知,W的数值所在的最小范围是36~36.3.
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | |
| 溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | |
 如图所示的转化关系中,A、B、C、D都是初中化学中常见的物质,A是人类赖以生存的一种无色液体,D是一种黑色固体(反应条件、其他反应物及多余的产物均已略去).
如图所示的转化关系中,A、B、C、D都是初中化学中常见的物质,A是人类赖以生存的一种无色液体,D是一种黑色固体(反应条件、其他反应物及多余的产物均已略去).