题目内容
15.化学与生活密切相关,下列做法合理的是( )| A. | 油锅着火用水浇灭 | B. | 电器着火用泡沫灭火器灭火 | ||
| C. | 用明火检查液化气罐是否漏气 | D. | 火场逃生时用湿毛巾捂住口鼻 |
分析 A、根据油着火的处理方法进行分析判断.
B、根据电器着火的处理方法、防触电的原进行分析判断.
C、根据可燃性气体泄露时的处理方法进行分析.
D、根据燃烧后生成的烟尘、有毒气体进行分析判断..
解答 解:A、油着火,不能用水浇灭,因为油的密度比水的小,会浮在水面,水起不到灭火的作用,故该做法错误.
B、电器着火,最先应当切断电源,防止中电,再用干粉灭火器灭火,故该做法错误.
C、液化气具有可燃性,遇到明火可能发生爆炸,故该做法错误.
D、火场逃生时用湿毛巾捂住口鼻,能防止吸入烟尘,故该做法正确.
故选D.
点评 化学来源于生产、生活,也服务于生产、生活,与生产、生活相关的化学知识,是中考热点之一,在学习过程中要理论联系实际,在实践中领会知识,运用所学知识去解决实际问题.

练习册系列答案
相关题目
14.为研究NaOH与盐酸的反应,同学们用以下试剂设计不同方案进行探究.
实验试剂:镁条、蒸馏水、稀盐酸、NaOH溶液、NaCl溶液等
(1)小明取少量NaOH溶液于试管中,滴入酚酞,溶液变红,再滴加稀盐酸,振荡,红色褪去,可推断NaOH与盐酸发生了反应.反应的化学方程式为NaOH+HCl═NaCl+H2O.
(2)小刚取体积相同的稀盐酸分别于甲、乙两支试管中,向甲中先加1mL水,充分混合后再放入镁条,向乙中先加入1mL NaOH溶液,充分混合后再放入镁条.观察到甲中有气泡冒出,乙中无气泡(或气泡少),可推断NaOH与盐酸发生了反应.
(3)小华利用溶液导电性进行实验.分别测定几种试剂的导电性,获得相关数据:
查阅资料:
Ⅰ.溶液中若存在自由移动的离子,通电时就会发生定向移动,从而形成了电流.
Ⅱ.相同电压下,等体积溶液中,所含离子数目越多,电流就越大.
①对比实验A、C的数据,可推知NaOH溶液中除水分子外还含有自由移动的Na+和OH-(填化学符号).
②实验B、D中电流强度相等,说明等体积的稀盐酸和NaCl溶液中所含Cl-的数目相等(填写“相等”或“不相等”).
③各取10mL NaOH溶液于两个小烧杯中,分别加入10mL NaCl溶液和10mL稀盐酸(所得混合溶液体积均约为20mL),测两种混合溶液的导电性,电流示数依次为I1和I2.根据I1> I2(填“>”、“<”或“=”),也可推断氢氧化钠和盐酸发生了反应.
实验试剂:镁条、蒸馏水、稀盐酸、NaOH溶液、NaCl溶液等
(1)小明取少量NaOH溶液于试管中,滴入酚酞,溶液变红,再滴加稀盐酸,振荡,红色褪去,可推断NaOH与盐酸发生了反应.反应的化学方程式为NaOH+HCl═NaCl+H2O.
(2)小刚取体积相同的稀盐酸分别于甲、乙两支试管中,向甲中先加1mL水,充分混合后再放入镁条,向乙中先加入1mL NaOH溶液,充分混合后再放入镁条.观察到甲中有气泡冒出,乙中无气泡(或气泡少),可推断NaOH与盐酸发生了反应.
(3)小华利用溶液导电性进行实验.分别测定几种试剂的导电性,获得相关数据:
| 实验序号 | A | B | C | D |
| 试剂 | 蒸馏水 | 稀盐酸 | NaOH溶液 | NaCl溶液 |
| 电流强度/mA | 约为0 | 0.09 | 0.09 | 0.09 |
Ⅰ.溶液中若存在自由移动的离子,通电时就会发生定向移动,从而形成了电流.
Ⅱ.相同电压下,等体积溶液中,所含离子数目越多,电流就越大.
①对比实验A、C的数据,可推知NaOH溶液中除水分子外还含有自由移动的Na+和OH-(填化学符号).
②实验B、D中电流强度相等,说明等体积的稀盐酸和NaCl溶液中所含Cl-的数目相等(填写“相等”或“不相等”).
③各取10mL NaOH溶液于两个小烧杯中,分别加入10mL NaCl溶液和10mL稀盐酸(所得混合溶液体积均约为20mL),测两种混合溶液的导电性,电流示数依次为I1和I2.根据I1> I2(填“>”、“<”或“=”),也可推断氢氧化钠和盐酸发生了反应.
15.甲、乙两化学兴趣小组用如图1所示的实验装置,通过测定产生相同体积氧气所用时间的长短来探究影响H2O2分解速率的因素.
(1)甲组:按如下设计的方案实验,请完成表1:
(2)乙组:按如下设计的方案实验,请完成表2:
(3)甲、乙两小组通过数次实验得出如图2所示的数据,请回答下列问题: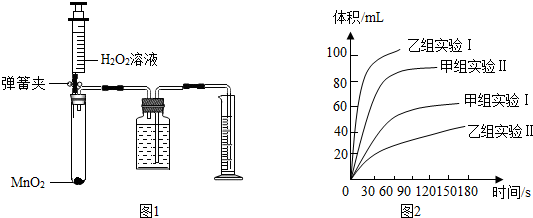
①从甲组实验得出的数据可知:H2O2浓度越大,分解速率越快.
②由乙组研究的影响H2O2分解因素的数据分析:相同条件下,H2O2在碱性(填“酸性”或“碱性”)环境下放出气体速率较快;写出H2O2分解的化学反应方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O.
【发现问题】实验开始时,H2O2溶液的温度为25℃;实验结束时,溶液的温度明显升高.说明H2O2分解是放热(选填“放热”或“吸热”)反应.
【注意:若答对第(5)小题将奖励 4分,化学卷总分不超过60分】
【反思运用】同学们经过讨论、交流和网上搜资料,提出下面两种制取H2O2液的方 法:
①用Na2O2(过氧化钠)与 H2SO4溶液作反应物,反应时将温度控制在-5~+5℃范围,生成的Na2SO4,会以
Na2SO4•10H2O晶体的形式析出,反应原理为 Na2O2+H2S04+10H2O═NaSO4•10H2O+H20,制取时Na2O2的量不能过量,因为Na2O2与水反应会生成NaOH.若Na2O2过量会造成(在碱性环境中)生成的过氧化氢分解.
②用BaO2(过氧化鋇)与H2SO4溶液作反应物.在常温下就可反应生成H2O2,试写出反应的化学方程式BaO2+H2SO4=BaSO4↓+H2O2.方法“②”比方法“①”更易操作,理由是方法①要控制好反应的温度,才能使Na2SO4•10H2O晶体析出,而方法②生成的硫酸钡是沉淀,容易与过氧化氢溶液分离.
(1)甲组:按如下设计的方案实验,请完成表1:
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| Ⅰ | 探究溶液的浓度对H2O2分解速率的影响 | 25℃ | 0.2gMnO2 | 10mL 4%H2O2 |
| Ⅱ | 25℃ | 0.2gMnO2 | 10mL 8%H2O2 |
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 | 实验时溶液 酸碱度 |
| Ⅰ | 探究溶液的酸碱性 对H2O2分解速率的影响 | 25℃ | 0.2gMnO2 | 0mL 8%H2O2 | pH=10.0 |
| Ⅱ | 25℃ | 0.2gMnO2 | 0mL 8%O2 | pH=4.0 |

①从甲组实验得出的数据可知:H2O2浓度越大,分解速率越快.
②由乙组研究的影响H2O2分解因素的数据分析:相同条件下,H2O2在碱性(填“酸性”或“碱性”)环境下放出气体速率较快;写出H2O2分解的化学反应方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O.
【发现问题】实验开始时,H2O2溶液的温度为25℃;实验结束时,溶液的温度明显升高.说明H2O2分解是放热(选填“放热”或“吸热”)反应.
【注意:若答对第(5)小题将奖励 4分,化学卷总分不超过60分】
【反思运用】同学们经过讨论、交流和网上搜资料,提出下面两种制取H2O2液的方 法:
①用Na2O2(过氧化钠)与 H2SO4溶液作反应物,反应时将温度控制在-5~+5℃范围,生成的Na2SO4,会以
Na2SO4•10H2O晶体的形式析出,反应原理为 Na2O2+H2S04+10H2O═NaSO4•10H2O+H20,制取时Na2O2的量不能过量,因为Na2O2与水反应会生成NaOH.若Na2O2过量会造成(在碱性环境中)生成的过氧化氢分解.
②用BaO2(过氧化鋇)与H2SO4溶液作反应物.在常温下就可反应生成H2O2,试写出反应的化学方程式BaO2+H2SO4=BaSO4↓+H2O2.方法“②”比方法“①”更易操作,理由是方法①要控制好反应的温度,才能使Na2SO4•10H2O晶体析出,而方法②生成的硫酸钡是沉淀,容易与过氧化氢溶液分离.
3.ClO2是优良的饮用水消毒剂.ClO2中氯元素的化合价是( )
| A. | +5 | B. | +4 | C. | +2 | D. | -1 |
10.为了检测石灰石样品中碳酸钙的含量,甲、乙、丙、丁、戊五位同学分别用质量分数相同的盐酸与样品充分反应进行实验测定(样品中的杂质不溶于水,且不与盐酸反应),测得数据如表.
求:(1)碳酸钙质量分数;(计算结果精确至0.1%)
(2)稀盐酸中溶质质量分数.(计算结果精确至0.1%)
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 所取石灰石样品的质量/g | 22 | 22 | 22 | 22 | 22 |
| 加入盐酸的质量/g | 20 | 40 | 60 | 80 | 100 |
| 烧杯内剩余物的质量/g | 39.8 | 57.6 | 75.4 | 93.2 | 93.2 |
(2)稀盐酸中溶质质量分数.(计算结果精确至0.1%)
4.有关二氧化硅的反应中,属于置换反应的是( )
| A. | SiO2+4HF→SiF4↑+2H2O | B. | SiO2+CaO $\stackrel{高温}{→}$ CaSiO3 | ||
| C. | SiO2+2C$\stackrel{高温}{→}$Si+2CO↑ | D. | SiO2+2NaOH→Na2SiO3+H2O |
1.滨海北依黄河故道,被誉为是江淮第一门户,淡水资源比较丰富.东临黄海,拥有丰富的海洋资源.
(1)海水中富含钾、钙、镁等,这里的“钾、钙、镁”指的是元素(选填“元素”、“原子”).
(2)珍爱水资源,是每个公民应尽的义务.下列做法有利于保护水资源的是AD(填序号)
A、合理使用化肥农药 B.生活污水直接排放 C.使用含磷洗衣粉 D、工业废水处理达标后排放
(3)图1所示装置可以对河水进行简单净化.其中能起到吸附作用的是活性炭,可用肥皂水鉴别净化后的水是硬水还是软水,若要得到纯度更高的水,实验室中常采用的方法是蒸馏.
(4)高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂,其中铁元素的化合价是+6.
(5)用如图2装置可以证明水的组成.b管中产生的气体是氢气.该实验中,常往水里加入少量的硫酸钠以增强水的导电性,而硫酸钠的质量不变.现将0.2g的硫酸钠溶解在49.8g水中,一段时间后,硫酸钠的质量分数为0.8%,则有25g水被电解.

(6)氯化钠是一种重要的资源,在海水中储量很丰富.
①海水晒盐是海水在常温下蒸发得到氯化钠.实验室用氯化钠溶液模拟该过程如图3:已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是A(填编号),与B溶液中溶质质量分数相等的溶液是CD(填编号)
②如表是NaCl和KNO3在不同温度时的溶解度,NaCl和KNO3在t℃时的溶解度均为Wg,分析如表可推知,W的数值所在的最小范围是36~36.3.
(1)海水中富含钾、钙、镁等,这里的“钾、钙、镁”指的是元素(选填“元素”、“原子”).
(2)珍爱水资源,是每个公民应尽的义务.下列做法有利于保护水资源的是AD(填序号)
A、合理使用化肥农药 B.生活污水直接排放 C.使用含磷洗衣粉 D、工业废水处理达标后排放
(3)图1所示装置可以对河水进行简单净化.其中能起到吸附作用的是活性炭,可用肥皂水鉴别净化后的水是硬水还是软水,若要得到纯度更高的水,实验室中常采用的方法是蒸馏.
(4)高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂,其中铁元素的化合价是+6.
(5)用如图2装置可以证明水的组成.b管中产生的气体是氢气.该实验中,常往水里加入少量的硫酸钠以增强水的导电性,而硫酸钠的质量不变.现将0.2g的硫酸钠溶解在49.8g水中,一段时间后,硫酸钠的质量分数为0.8%,则有25g水被电解.

(6)氯化钠是一种重要的资源,在海水中储量很丰富.
①海水晒盐是海水在常温下蒸发得到氯化钠.实验室用氯化钠溶液模拟该过程如图3:已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是A(填编号),与B溶液中溶质质量分数相等的溶液是CD(填编号)
②如表是NaCl和KNO3在不同温度时的溶解度,NaCl和KNO3在t℃时的溶解度均为Wg,分析如表可推知,W的数值所在的最小范围是36~36.3.
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | |
| 溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | |